1、选择题 X、Y为两种短周期元素,Y的原子序数比X大2。下列判断正确的是
A.若X、Y同主族,则Y原子半径大于X原子半径
B.若X、Y同周期,则X、Y只能形成离子化合物
C.若X为碳元素,则Y的气态氢化物的分子为非极性分子
D.若X为铝元素,则Y最高价氧化物对应的水化物为强酸
2、填空题 (11分)A、B、C、D、E、F六种短周期主族元素,它们的原子序数依次增大;A有多种核素,其中一种没有中子;B元素的最高价氧化物对应水化物与其氢化物能生成盐;D与A同主族,且与E同周期;E元素原子的最外层电子数是其次外层电子数的3/4,A、B、D、E这四种元素,每一种与C元素都能形成原子个数比不同的多种化合物。请回答下列问题:
(1) F在元素周期表中的位置是_______________;用电子式表示A与F两种元素组成的化合物的
形成过程______________________________________________。
已知下表中的数据是破坏1 mol物质中的化学键所吸收的能量(kJ),元素A的单质与元素F的单质在一定条件下反应生成2mol产物时释放的能量为____________kJ。
化学键
| Cl2
| Br2
| I2
| HCl
| HBr
| HI
| H2
|
能量(kJ)
| 243
| 193
| 151
| 432
| 366
| 298
| 436
|
(2)用离子方程式表示E、F两种元素的非金属性强弱?
还可以验证E、F两种元素非金属强弱的是(填写字母)?
A.比较这两种元素的常见单质的沸点?
B.比较这两种元素的单质与氢气化合的难易?
C.比较这两种元素的最高价氧化物水化物的酸性
(3) A、C、E两两之间可形成甲、乙两种微粒,它们均为带一个单位负电荷的双原子阴离子,且甲有18个电子,乙有10个电子,则甲与乙反应的离子方程式为?
3、填空题 (10分)A、B、C为短周期元素,在周期表中所处的位置如图所示,A、C两种元素的原子核外电子数之和等于B原子的质子数,B2-的结构示意图为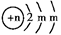 ,请回答下列问题:
,请回答下列问题:

(1)写出A、B、两种元素的符号:A ?,B?。?
(2)B位于周期表中第?周期第?族。
(3)C的氢化物的电子式为??;
(4)BC6作致冷剂替代氟利昂,对臭氧层完全没有破坏作用,是一种很有发展潜力的致冷剂,且BC6在温度高于45度以上时为气态,BC6属于??(填“离子”、“共价”)化合物。
4、填空题 (14分)填写下列空白:
(1)写出表示含有8个质子、10个中子的原子的化学符号:?;
(2)周期表中最活泼的非金属元素位于第?族;
(3)所含元素种类是8种的周期是第?、?周期。
(4)氯元素在周期表中位于第?周期第?族。氯的最高价氧化物的化学式为?,最高价氧化物的水化物的化学式为__________。
(5)物质在下列变化过程中克服的是:①共价键 ②离子键。(填序号)
HCl溶于水??电解熔融NaCl制Na?
电解水分解生成O2和H2?
(6)在下述反应中,属于取代反应的是?;属于氧化反应的是?;属于加成反应的是?。
①乙烯使溴水褪色 ②乙烯使酸性高锰酸钾溶液褪色③苯与浓硝酸制硝基
5、选择题 下列说法正确的是



A.碱金属单质的熔点随原子序数的增大而降低

B.砹位于第七周期第VIIA族,其氢化物的稳定性大于氯化氢

C.硒的最高价氧化物对应水化物的酸性比硫酸强

D.第二周期非金属元素的气态氢化物溶于水后,水溶液均为酸性