1、选择题 X、Y为两种短周期元素,Y的原子序数比X大2。下列判断正确的是
A.若X、Y同主族,则Y原子半径大于X原子半径
B.若X、Y同周期,则X、Y只能形成离子化合物
C.若X为碳元素,则Y的气态氢化物的分子为非极性分子
D.若X为铝元素,则Y最高价氧化物对应的水化物为强酸
参考答案:A
本题解析:A.若X、Y同主族,则X必为H,Y必为Li;B.若X、Y同周期,则X、Y也可能形成分子化合物,如二氧化碳;C.若X为碳元素,则Y为O,其的气态氢化物的分子H2O,为极性分子;D.若X为铝元素,则Y为P,其最高价氧化物对应的水化物为磷酸,虽为中强酸,但仍属于弱酸;
本题难度:一般
2、填空题 (11分)A、B、C、D、E、F六种短周期主族元素,它们的原子序数依次增大;A有多种核素,其中一种没有中子;B元素的最高价氧化物对应水化物与其氢化物能生成盐;D与A同主族,且与E同周期;E元素原子的最外层电子数是其次外层电子数的3/4,A、B、D、E这四种元素,每一种与C元素都能形成原子个数比不同的多种化合物。请回答下列问题:
(1) F在元素周期表中的位置是_______________;用电子式表示A与F两种元素组成的化合物的
形成过程______________________________________________。
已知下表中的数据是破坏1 mol物质中的化学键所吸收的能量(kJ),元素A的单质与元素F的单质在一定条件下反应生成2mol产物时释放的能量为____________kJ。
化学键
| Cl2
| Br2
| I2
| HCl
| HBr
| HI
| H2
|
能量(kJ)
| 243
| 193
| 151
| 432
| 366
| 298
| 436
|
(2)用离子方程式表示E、F两种元素的非金属性强弱?
还可以验证E、F两种元素非金属强弱的是(填写字母)?
A.比较这两种元素的常见单质的沸点?
B.比较这两种元素的单质与氢气化合的难易?
C.比较这两种元素的最高价氧化物水化物的酸性
(3) A、C、E两两之间可形成甲、乙两种微粒,它们均为带一个单位负电荷的双原子阴离子,且甲有18个电子,乙有10个电子,则甲与乙反应的离子方程式为?
参考答案:(第1空1分,其余空2分)
(1) 第三周期ⅦA族;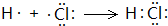 ;185
;185
(2)Cl2+S2-=2Cl-+S↓或Cl2+H2S=2H++2Cl-+S↓ ; BC
(3)HS-+OH-=S2-+H2O
本题解析:A、B、C、D、E、F六种短周期主族元素,它们的原子序数依次增大,A有多种核素,其中一种没有中子,则A为H元素;B元素的最高价氧化物对应水化物与其氢化物能生成盐,则B为N元素;E元素原子的最外层电子数是其次外层电子数的3/4,最外层电子数为6,则E为S元素;D与A同主族,且与E同周期,则D为Na;A、B、D、E这四种元素,每一种与C元素都能形成元素的原子个数比不相同的多种化合物,则C为O元素;F原子序数最大,则F为Cl元素;(1)F为Cl元素,在元素周期表中的位置是:第三周期ⅦA族;H与Cl两种元素组成的化合物为HCl,用电子式表示HCl的形成过程为: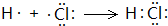 ,反应方程式为H2+Cl2=2HCl,反应生成2mol产物时释放的能量=2×432kJ-(436kJ+243kJ)=185kJ;(2)用离子方程式表示S、Cl两种元素的非金属性强弱为:Cl2+S2-=S↓+2Cl-,可以根据单质与氢气反应的难易程度及最高价氧化物对应水化物的酸性强弱比较非金属性强弱,单质沸点属于物理性质,不能比较非金属性强弱,故A错误,BC正确;(3)H、O、S形成的负一价双原子阴离子,且甲有18个电子,乙有10个电子,则甲为HS-,乙为OH-,离子反应为HS-+OH-=S2-+H2O。
,反应方程式为H2+Cl2=2HCl,反应生成2mol产物时释放的能量=2×432kJ-(436kJ+243kJ)=185kJ;(2)用离子方程式表示S、Cl两种元素的非金属性强弱为:Cl2+S2-=S↓+2Cl-,可以根据单质与氢气反应的难易程度及最高价氧化物对应水化物的酸性强弱比较非金属性强弱,单质沸点属于物理性质,不能比较非金属性强弱,故A错误,BC正确;(3)H、O、S形成的负一价双原子阴离子,且甲有18个电子,乙有10个电子,则甲为HS-,乙为OH-,离子反应为HS-+OH-=S2-+H2O。
本题难度:一般
3、填空题 (10分)A、B、C为短周期元素,在周期表中所处的位置如图所示,A、C两种元素的原子核外电子数之和等于B原子的质子数,B2-的结构示意图为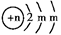 ,请回答下列问题:
,请回答下列问题:

(1)写出A、B、两种元素的符号:A ?,B?。?
(2)B位于周期表中第?周期第?族。
(3)C的氢化物的电子式为??;
(4)BC6作致冷剂替代氟利昂,对臭氧层完全没有破坏作用,是一种很有发展潜力的致冷剂,且BC6在温度高于45度以上时为气态,BC6属于??(填“离子”、“共价”)化合物。
参考答案:(1)N? S?(2)ⅥA?(3)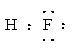 (4) 共价
(4) 共价
本题解析:(1)根据B离子的结构示意图可知,m=8,所以B是S。所以根据元素在周期表中的位置可知,A是N,C是F。
(3)S位于周期表的第三周期第ⅥA族。
(3)氟化氢是含有极性键的共价化合物,电子式为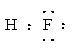 。
。
(4)BC6在温度高于45度以上时为气态,这说明该化合物析出的晶体是分子晶体,所以BC6属于共价化合物。
本题难度:一般
4、填空题 (14分)填写下列空白:
(1)写出表示含有8个质子、10个中子的原子的化学符号:?;
(2)周期表中最活泼的非金属元素位于第?族;
(3)所含元素种类是8种的周期是第?、?周期。
(4)氯元素在周期表中位于第?周期第?族。氯的最高价氧化物的化学式为?,最高价氧化物的水化物的化学式为__________。
(5)物质在下列变化过程中克服的是:①共价键 ②离子键。(填序号)
HCl溶于水??电解熔融NaCl制Na?
电解水分解生成O2和H2?
(6)在下述反应中,属于取代反应的是?;属于氧化反应的是?;属于加成反应的是?。
①乙烯使溴水褪色 ②乙烯使酸性高锰酸钾溶液褪色③苯与浓硝酸制硝基
参考答案:(1)188O?(2)ⅦA?(3)二?三? (4) 三?ⅦA? Cl2O7?HClO4?
(5)① 、② 、①?(6).③;②;①
本题解析:略
本题难度:简单
5、选择题 下列说法正确的是



A.碱金属单质的熔点随原子序数的增大来源:91考试网 91Exam.org而降低

B.砹位于第七周期第VIIA族,其氢化物的稳定性大于氯化氢

C.硒的最高价氧化物对应水化物的酸性比硫酸强

D.第二周期非金属元素的气态氢化物溶于水后,水溶液均为酸性
参考答案:A
本题解析:略
本题难度:简单