1、选择题 从单质氟到碘,下列情况中不能反映出它们的氧化性强弱不同的是(?)
A.单质跟卤化物之间的置换情况
B.跟银结合而形成的卤化银的颜色变化情况
C.跟氢气反应的情况
D.跟水反应的情况
参考答案:B
本题解析:单质的氧化性强弱,即为单质的得电子能力;可以卤素之间的置换,跟氢气反应的难易,跟水反应的情况来判断,不能从物理性质如:颜色、状态、密度、溶解度等来判断,也不能从其化合物的颜色来判断。
本题难度:简单
2、选择题 下列关于非金属元素的叙述中正确的是
A.非金属元素的原子最外层电子数都大于或等于4
B.非金属元素的原子都易得电子生成相应的阴离子
C.只由非金属元素组成的晶体一定属于分子晶体
D.每一个主族包含的元素中不一定都有非金属元素
参考答案:D
本题解析:A项中H、He的最外层电子数分别为1、2,错;B项中C,Si等元素不易得电子,错;C项NH4Cl为离子晶体,错;D项ⅡA族全是金属元素,对
点评:该类题型题目涉及的面较广,需要学生在掌握一般规律的基础上,运用特殊举例的方法,难度一般
本题难度:简单
3、选择题 下列各项所述的两个量,前者一定大于(或高于)后者的是( )
A.F2和Br2的沸点
B.H-和H+的离子半径
C.同温下同压分别在1升水中最多能溶解的Cl2和SO2的体积
D.在NH3+NO→N2+H2O反应中,被氧化和被还原的N原子数
参考答案:A.F2和Br2都属于分子晶体,物质的相对分子质量越大,分子间作用力越强,沸点越高,常温下,F2为气体,Br2为液体,故A错误;;
B.H-核外有1个电子层,H+核外没有电子,电子层数越多,半径越大,所以H-大于H+的离子半径,故B正确;
C.Cl2微溶于水,SO2易溶于水,同温下同压分别在1升水中溶解的SO2多,故C错误;
D.在NH3+NO→N2+H2O反应中,NH3被氧化,NO被还原,反应的化学方程式为4NH3+6NO=5N2+6H2O,被氧化和被还原的N原子数比为2:3,后者大,故D错误.
故选B.
本题解析:
本题难度:简单
4、填空题 (5分)禽流感病毒是一种没有超常抵抗力的病毒。漂白粉是常用的消毒剂,可以将禽流感病毒杀灭。
(1) 漂白粉的有效成分是???(填化学式)。
(2) 工业上制取漂白粉,化学反应方程式为?????。
(3) 漂白粉溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,化学反应方程式为?????。
参考答案:(5分)
(1) Ca(ClO)2?(1分);
(2) 2Ca(OH)2 + 2Cl2 ?="=" Ca(ClO)2 + CaCl2 + 2H2O? (2分)
(3) Ca(ClO)2 + CO2 + H2O ="=" CaCO3 ↓+ 2HClO? (2分)
本题解析:(1)漂白粉的有效成分是次氯酸钙化学式为:Ca(ClO)2?
(2)工业上将氯气通入石灰水中制取漂白粉,反应的方程式为
2Ca(OH)2 + 2Cl2 ?="=" Ca(ClO)2 + CaCl2 + 2H2O
(3)漂白粉溶于水中,由于碳酸的酸性比次氯酸强所以次氯酸钙会空气中的二氧化碳反应生成次氯酸,产生漂泊消毒的作用,反应的方程式为
Ca(ClO)2 + CO2 + H2O ="=" CaCO3 ↓+ 2HclO。
本题难度:一般
5、计算题 已知Cl-和Ag+反应生成AgCl,每次新生成的AgCl中又有10%见光分解成单质银和氯气,氯气又可在水溶液中岐化成HClO3(为强酸)和HCl。而这样生成的Cl-又与剩余的Ag+作用生成沉淀,如此循环往复,直至最终。现有含1.1molNaCl的溶液,向其中加入足量AgNO3,求最终能生成多少克难溶物(AgCl和Ag)?若最后溶液体积为1L,求溶液中H+物质的量浓度是多少?
参考答案:167.94g? 0.12mol/L
本题解析:本题涉及三个化反应:Ag++Cl-=AgCl↓,2AgCl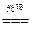 2Ag+Cl2;3Cl2+3H2O=6H++ClO3-+5Cl-,
2Ag+Cl2;3Cl2+3H2O=6H++ClO3-+5Cl-,
若有①60Ag++60Cl-=60AgCl,则应有②6AgCl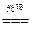 6Ag+3Cl2,③3Cl2+3H2O=ClO3-+5Cl-+6H+,消去循环量,可运用总反应式求解,①+②+③得:60Ag++55Cl-+3H2O=54AgCl↓+6Ag↓+ClO3-+6H+。
6Ag+3Cl2,③3Cl2+3H2O=ClO3-+5Cl-+6H+,消去循环量,可运用总反应式求解,①+②+③得:60Ag++55Cl-+3H2O=54AgCl↓+6Ag↓+ClO3-+6H+。
据此易得: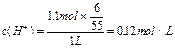 ;
;
难溶物AgCl和Ag的质量为:
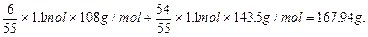
本题难度:一般