|
高中化学知识点大全《影响盐类水解的因素》练习题(二)
2019-06-28 22:55:59
【 大 中 小】
|
1、填空题 现有下列10种物质:
①NaHCO3;②NH4HCO3;③BaSO4;④HF;⑤C2H5OH;⑥Al;⑦食盐水;⑧CH3COOH;?⑨HCl; ⑩NaOH。
(1)其中属于非电解质的是_____________(填序号,下同),既能跟盐酸反应又能跟NaOH溶液反应的是_____________。
(2)NaHCO3溶液显?性(填“酸”、“碱”或“中”),原因是(结合离子方程式表示)
?。
(3)常温时有四种溶液:Ⅰ.pH=4的CH3COOH溶液;Ⅱ.pH=4的HCl溶液;Ⅲ.pH=10的NaOH溶液;Ⅳ.pH=10的CH3COONa溶液。(已知常温时醋酸的电离常数为1.75×10-5)
下列有关叙述正确的是?。(忽略溶液混合时的体积变化)
A.Ⅱ、Ⅲ溶液分别与10g铝粉充分反应,生成H2的量Ⅲ一定更多
B.Ⅰ与Ⅱ等体积混合后,溶液中的c(CH3COO-)为原溶液浓度的1/2
C.将Ⅰ和Ⅲ等体积混合后,溶液pH一定小于7
D.四种溶液各10mL分别加水稀释至100mL后,溶液的pH:Ⅲ>Ⅳ>Ⅰ>Ⅱ
| (4)常温时某HCl溶液中由水电离出的C(H+)=1×10-amol/L,而相同pH的AlCl3溶液中由水电离出的C(H+)=1×10-bmol/L (已知a, b均为小于14的正整数),则a和b之间满足的关系为??,?(用一个等式和一个不等式表示)。
参考答案:(共14分,每空2分)
(1)⑤(有错计0分) ①②⑥(对两个计1分,全对2分,有错0分)
(2) 碱 ? HCO3-+H2O? ?H2CO3+ OH-,?HCO3- ?H2CO3+ OH-,?HCO3- CO32-+H+ 因水解程度大于电离 CO32-+H+ 因水解程度大于电离
程度,所以溶液显碱性(合理答案均可,只要写出水解方程式即计满分)
(3)? C?(有错0分)
(4)? a + b = 14? ? a? >? b
本题解析:(1)非电解质是指在熔融状态下或水溶液中不能导电的化合物。故属于非电解质的是⑤。既能跟盐酸反应又能跟NaOH溶液反应的是①②⑥。
(2)NaHCO3是强碱弱酸盐,水解呈碱性,水解的离子方程式为HCO3-+H2O? ?H2CO3+ OH-,?HCO3- ?H2CO3+ OH-,?HCO3- CO32-+H+。 CO32-+H+。
(3)A项:酸的浓度和碱的浓度一样,Al的质量相同,生成的H2的量也一样,故错。
B项:CH3COOH是弱电解质,部分电离,故溶液中的c(CH3COO-)为原溶液浓度的小于1/2,故错。
D项:CH3COONa是强碱弱酸盐,部分水解,加水稀释促进水解,CH3COOH是弱电解质,部分电离,加水稀释促进电离,故溶液的pH:Ⅳ >Ⅲ>Ⅱ>Ⅰ,故错。
故选C。
(4)HCl是强电解质,全部电离,AlCl3是强酸弱碱盐,发生水解,则则a和b之间满足的关系为a + b = 14 ;a? >? b。
点评:本题重点考查的是非电解质的判断和盐类水解的知识,题目难打较大,注意对基础知识的学习及应用。
本题难度:一般
2、填空题
(10分)(1)AgNO3的水溶液呈?(填“酸”、“中”、“碱”)性,常温时的pH ?7(填“>”、“=”、“<”),原因是(用离子方程式表示):?;?实验室在配制AgNO3的溶液时,常将AgNO3固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓度,以?(填“促进”、“抑制”)其水解。
(2)氯化铝水溶液呈?性,原因是(用离子方程式表示):?________________ 。
把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是??。
(3)在配制硫化钠溶液时,为了防止发生水解,可以加入少量的??。
参考答案:(10分)(方程式2分,其余1分)
(1)酸,<,Ag++ H2O 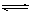 ?AgOH + H+,抑制。 ?AgOH + H+,抑制。
(2)酸,Al3++3H2O 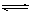 ?Al(OH)3+3H+, Al2O3?; ?Al(OH)3+3H+, Al2O3?;
(3)NaOH
本题解析:(1)AgNO3为强酸弱碱盐,水溶液呈酸性,常温时的pH <7,原因是:Ag++ H2O 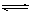 ?AgOH + H+,实验室在配制AgNO3的溶液时,常将AgNO3固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓度,以抑制其水解。 ?AgOH + H+,实验室在配制AgNO3的溶液时,常将AgNO3固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓度,以抑制其水解。
(2)氯化铝为强酸弱碱盐,水溶液呈酸性,其原因是:Al3++3H2O 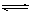 ?Al(OH)3+3H+,当把把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是Al2O3; ?Al(OH)3+3H+,当把把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是Al2O3;
(3)硫化钠溶液为强碱弱酸盐,水溶液呈碱性,为了防止发生水解,可以加入少量的NaOH
本题难度:一般
3、选择题 下列溶液中有关物质的浓度关系正确的是? (? )
A.c(NH4+)相等的NH4HCO3、NH4HSO4、NH4Cl溶液中:c (NH4HSO4) ﹥c(NH4HCO3) ﹥c(NH4Cl)
B.向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液中:C(Na+)﹥C(CH3COO-)﹥C(H+)﹥C(OH-)
C.1.0mol/LNa2CO3溶液中:C(OH-)=C(HCO3-)+C (H+)+2C(H2CO3)
D.某二元弱酸的酸式盐NaHA溶液中:C(H+)+C(Na+)=C(OH-)+C(HA-)+C(A2-)
参考答案:C
本题解析:在三种盐溶液中都存在水解平衡:NH4++H2O NH3·H2O+OH-;由于在NH4HCO3中还存在平衡:HCO3-+H2O NH3·H2O+OH-;由于在NH4HCO3中还存在平衡:HCO3-+H2O H2CO3-+H+;二者水解的酸碱性可以相互促进,使c(NH4+)减小。在NH4HSO4中电离产生的H+对NH4+水解起抑制作用,使c(NH4+)增大。因此c(NH4+)相等的NH4HCO3、NH4HSO4、NH4Cl溶液中c(NH4HCO3) ﹥c(NH4Cl) ﹥c (NH4HSO4)。错误。B.向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液,所以:C(H+)﹥C(OH-)。根据电荷守恒可得C(Na+)+ C(H+)=C(CH3COO-)+C(OH-)。将1式代入2式可得C(CH3COO-)﹥C(Na+)。盐的大量大于弱电解质的电离,所以C(Na+)﹥C(H+)。因此离子浓度的关系是:C(CH3COO-)﹥C(Na+)﹥C(H+)﹥C(OH-)。错误。C.1.0mol/LNa2CO3溶液中根据质子守恒可得:C(OH-)=C(HCO3-)+C (H+)+2C(H2CO3)。正确。D.某二元弱酸的酸式盐NaHA溶液中,根据电荷守恒可得:C(H+)+C(Na+)=C(OH-)+C(HA-)+2C(A2-)。错误。 H2CO3-+H+;二者水解的酸碱性可以相互促进,使c(NH4+)减小。在NH4HSO4中电离产生的H+对NH4+水解起抑制作用,使c(NH4+)增大。因此c(NH4+)相等的NH4HCO3、NH4HSO4、NH4Cl溶液中c(NH4HCO3) ﹥c(NH4Cl) ﹥c (NH4HSO4)。错误。B.向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液,所以:C(H+)﹥C(OH-)。根据电荷守恒可得C(Na+)+ C(H+)=C(CH3COO-)+C(OH-)。将1式代入2式可得C(CH3COO-)﹥C(Na+)。盐的大量大于弱电解质的电离,所以C(Na+)﹥C(H+)。因此离子浓度的关系是:C(CH3COO-)﹥C(Na+)﹥C(H+)﹥C(OH-)。错误。C.1.0mol/LNa2CO3溶液中根据质子守恒可得:C(OH-)=C(HCO3-)+C (H+)+2C(H2CO3)。正确。D.某二元弱酸的酸式盐NaHA溶液中,根据电荷守恒可得:C(H+)+C(Na+)=C(OH-)+C(HA-)+2C(A2-)。错误。
本题难度:一般
4、选择题 下列变化不属于盐类水解反应的是(?)
①NH3+H2O NH4++OH-?②HCO3- + H2O NH4++OH-?②HCO3- + H2O H2CO3+OH- H2CO3+OH-
③HCO3-+H2O  H3O++CO32-?④A13+ +3HCO3-=Al(OH)3↓+3CO2↑ H3O++CO32-?④A13+ +3HCO3-=Al(OH)3↓+3CO2↑
⑤A1O2-+HCO3-+H2O=Al(OH)3↓+CO32-?⑥NH4++2H2O  NH3·H2O+H3O+ NH3·H2O+H3O+
A.①③⑤
B.②③⑤
C.①④⑤
D.①③
参考答案:A
本题解析:①是化学平衡,③是电离平衡,⑤是复分解反应。所以正确的答案是A。
本题难度:简单
5、简答题 下列电解质溶液的有关叙述正确的是( )
A.同浓度、同体积的强酸与强碱溶液混合后,溶液的pH=7
B.在含有BaSO4沉淀的溶液中加入Na2SO4固体,c(Ba2+)增大
C.含1?mol?KOH的溶液与1?mol?CO2完全反应后,溶液中c(K+)=c(HCO )
D.在CH3COONa溶液中加入适量CH3COOH,可使c(Na+)=c(CH3COO-)
参考答案:A、强酸强碱不一定是一元强酸和一元强碱,等浓度等体积混合可能酸过量或碱过量,故A错误;
B、在一定温度下溶度积为常数,硫酸根离子浓度增大,平衡逆向进行,钡离子浓度减小,故B错误;
C、含l mol KOH的溶液与l mol CO2完全反应后生成碳酸氢钾,碳酸氢根离子水解,c(K+)=c(HCO3-),故C错误;
D、在CH3COONa溶液中加入适量CH3COOH,依据电荷守恒;c(H+)+c(Na+)=c(CH3COO-)+c(OH-),当c(H+)=c(OH-)时,c(Na+)=c(CH3COO-),故D正确;
故选D.
本题解析:
本题难度:一般
|