1、选择题 物质的量浓度相同的三种盐NaX、NaY、NaZ的溶液,其pH依次为8、9、10,则HX、HY、HZ的酸性由强到弱的顺序是(? )
A.HX、HY、HZ
B.HX、HZ、HY
C.HZ、HY、HX
D.HY、HZ、HX
参考答案:A
本题解析:略
本题难度:一般
2、选择题 常温下,用 0.1 mol·L—1HCl溶液滴定10.0 mL浓度为0.1 mol·L—1 Na2CO3溶液,所得滴定曲线如图所示。下列说法正确的是
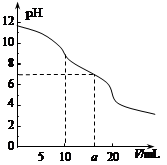
A.当V=0时:c(H+)+c(HCO 3-)+c(H2CO3)=c(OH-)
B.当V=5时:c(CO32—)+c(HCO 3-)+c(H2CO3)=2c(Cl-)
C.当V=10时:c(Na+)>c(HCO 3-)>c(CO32—)>c(H2CO3)
D.当V=a时:c(Na+)>c(Cl-)>c(H+)=c(OH-)
参考答案:BD
本题解析:A、溶液中氢氧根离子和氢离子均是水电离出来的,水电离出的氢离子和氢氧根离子相等,故c(H+)+c(HCO 3-)+2c(H2CO3)=c(OH-),故A错误;B、当V=5时,溶液中加入了0.005mol的氯离子,根据碳元素守恒可得,反应前和反应后溶液中均有n(CO32—)+n(HCO 3-)+n(H2CO3)=0.001mol,故三者的物质的量之和与氯离子的物质的量之比为2:1,故浓度之和等于氯离子浓度之和得2倍,故B正确;C、当V=10时,碳酸钠和盐酸恰好完全反应生成碳酸氢钠,在碳酸氢钠溶液中,碳酸氢根离子的水解程度大于电离程度,故c(H2CO3)>c(CO32-),故C错误;D、溶液中有碳酸氢钠和氯化钠,故钠离子的浓度大于氯离子的浓度,溶液呈中性,氢离子的浓度等于氢氧根离子的浓度,故D正确;故选BD。
本题难度:一般
3、选择题 在蒸发皿中用酒精灯加热蒸干下列物质的溶液然后灼烧,可得到该物质固体的是(?)
A.Al2(SO4)3
B.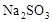
C.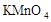
D.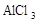
参考答案:A
本题解析:硫酸铝水解生成氢氧化铝和硫酸,硫酸不挥发,所以蒸干硫酸铝溶液得到硫酸铝固体;亚硫酸钠溶液加热蒸干过程中亚硫酸钠被氧化成硫酸钠,高锰酸钾溶液加热蒸干过程中高锰酸钾发生分解;氯化铝水解生成氢氧化铝和盐酸,盐酸挥发,所以加热蒸干氯化铝溶液得到氢氧化铝甚至温度过高可能得到氧化铝。
点评:盐溶液蒸干过程中要考虑到水解、分解、氧化等情况。
本题难度:一般
4、选择题 下列方程式中,属于水解反应的是
A.H2O + H2O  H3O+ + OH—
H3O+ + OH—
B.HCO3— + OH— = H2O + CO32—
C.CO2 + H2O  H2CO3
H2CO3
D.CO32— + H2O  HCO3— + OH—
HCO3— + OH—
参考答案:D
本题解析:A是水的电离平衡,B是HCO3—和强碱的化学反应,C是CO2的化学平衡,所以正确的答案选D。
点评:盐的离子跟水电离出的氢离子或OH-生成弱电解质的反应是盐类的水解。水解反应可以看作是中和反应的逆反应,且水解大部分都是可逆的,据此可以判断是否为水解平衡。
本题难度:简单
5、选择题 常温下,向20 mL 0.2 mol/L H2A溶液中滴加0.2 mol/L NaOH溶液。有关微粒的物质的量变化如下图(其中I代表H2A,II代表HA-,III代表A2-)。根据下图图示判断,下列说法正确的是
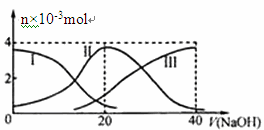
A.当V(NaOH)=20mL时,溶液中离子浓度大小关系:c(Na+)>c(HAˉ)>c(H+)>c(A2-)>c(OHˉ)
B.等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水的大
C.欲使NaHA溶液呈中性,可以向其中加入酸或碱
D.向NaHA溶液加入水的过程中,pH可能增大也可能减小
参考答案:A
本题解析:A、当V(NaOH)=20?mL时,酸和碱刚好反应生成NaHA,但此时H2A的浓度并不为0,而是以HAˉ、A2-、H2A三种形式存在,说明H2A为二元弱酸,从图像可知:c(HAˉ) > c(A2-) > H2A,说明HAˉ的电离程度大于水解程度,所以c(H+)>c(A2-)>c(OHˉ),结合电离理论分析,A正确;由于NaHA以电离为主,对水的电离有抑制作用,B错误;C、NaHA电离为主,水溶液成酸性,所以要加碱;D、NaHA水溶液成酸性,加水稀释氢离子浓度减小,pH增大。
本题难度:一般