1、选择题 下列叙述中正确的是
A.体积相同、浓度均为0.1mol/L的NaOH溶液、氨水,分别稀释m倍、n倍,溶液的pH都变成9,则m<n
B.有甲、乙两醋酸溶液,测得甲的pH=a,乙的pH=a+1,若用于中和等物质的量浓度等体积的NaOH溶液,需甲、乙两酸的体积V(乙)>10V(甲)
C.25℃,pH=9的NaOH溶液和NaAc溶液中,由水电离出的c(H+)均为10-5mol·L-1
D.c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-)该式满足NaHCO3溶液中的离子浓度关系。
参考答案:BD
本题解析:A:体积相同、浓度均为0.1mol/L的NaOH溶液、氨水,由于前者全部电离、后者部分电离,前者的pH大于后者,而在稀释过程,两者的pH均减小,但由于弱碱氨水中存在电离平衡,可补充部分OH—,导致氨水溶液的pH降低速率相对较小,故无法确定两溶液pH均为9时两者稀释的倍数大小
B:设甲、乙两醋酸溶液的电离度分别为α甲、α乙,由于前者酸性强,浓度较大,α甲相对较小;根据c(H+)=cα可知,c甲= ,c乙=
,c乙=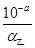 ;
;
依题意可知,两溶液所含有溶质的物质的量相等,即: V甲=
V甲=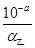 V乙,推得
V乙,推得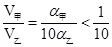 ,即V(乙)>10V(甲),正确
,即V(乙)>10V(甲),正确
C:NaOH溶液和NaAc溶液,前者OH—抑制了水的电离:H2O H++OH-,而后者弱离子水解促进水的电离,故两溶液中水电离出的c(H+)一定不相等,排除
H++OH-,而后者弱离子水解促进水的电离,故两溶液中水电离出的c(H+)一定不相等,排除
D:符合电荷守恒,正确
答案为BD
本题难度:一般
2、填空题 工业上用重晶石(BaSO4)制备BaCO3的常用方法主要有高温煅烧还原法、沉淀转化法等。高温煅烧还原法的工艺流程可简单的表示如下:
已知:BaSO4(s)+4C(s)=BaS(s)+4CO(g)△H="+571.2" kJ?mol-1
Ba(s)+S(s)+2O2(g):BaSO4(s)△H=—1473.2 kJ?mol-1
Ba(s)+S(s)=BaS(g)△H=—460 kJ?mol-1
请回答:
(1)工业上煅烧重晶石矿粉时,为使BaSO4得到充分还原和维持反应所需的高温,应采取的措施 是?。
(2)沉淀转化法制备BaCO3可用饱和Na2CO3溶液将BaSO4转化为BaCO3:
BaSO4(s)+CO2-3(aq)=BaCO3(s)+SO2-4(aq)
则:在实验室中将少量BaSO4沉淀全部转化为BaCO3的实验操作方法与步骤为
?
?
(3)与高温煅烧还原法相比,用饱和Na2CO3溶液沉淀转化法的优点主要有
?
?
参考答案:
(1)加入过量的碳,同时通入空气(2分)
(2)将适量饱和Na2CO3溶液加入BaSO4沉淀中,充分搅拌,静置、弃去上层清液;(2分)如此操作,反复多次(直到BaSO4全部转化为BaCO3)(2分)
(3)节能、环保等(2分)
本题解析:略
本题难度:一般
3、选择题 H2SO3是二元弱酸,NaHSO3溶液呈酸性。在0.1 mol·L-1 NaHSO3溶液中,下列关系正确的是(?)
A.c(HSO3-)>c(SO32-)>c(H2SO3)
B.c(Na+)=c(HSO3-)+2c(SO32-)+c(H2SO3)
C.c(Na+)=c(HSO3-)>c(H+)>c(OH-)
D.c(Na+)+c(H+)=c(HSO3-)+c(OH-)+c(SO32-)
参考答案:A
本题解析:A选项正确,NaHSO3溶液显酸性即HSO3-电离程度大于水解程度,所以c(SO32-)>c(H2SO3);B选项错误,不符合物料守恒式;C选项错误,由于亚硫酸氢根离子电离,钠离子的浓度大于亚硫酸氢根离子的浓度;D选项错误,应是2c(SO32-)。
本题难度:一般
4、填空题 已知某浓度的硫酸在水中的电离方程式:
H2SO4====H++HSO-4,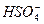
 H++
H++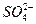 。
。
(1)Na2SO4溶液显________(填“酸性”“碱性”或“中性”),理由是(用离子方程式表示)_________。
(2)在25 ℃时0.1 mol·L-1的NaHSO4溶液中c(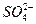 )="0.029" mol ·L-1,则25 ℃时,0.1 mol·L-1 H2SO4溶液中c(
)="0.029" mol ·L-1,则25 ℃时,0.1 mol·L-1 H2SO4溶液中c(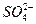 )________(填“大于”,“小于”或“等于”)0.029 mol ·L-1,理由是__________。
)________(填“大于”,“小于”或“等于”)0.029 mol ·L-1,理由是__________。
(3)在0.1 mol ·L-1 Na2SO4溶液中,下列粒子浓度关系正确的是(?)
A.c(Na+)+c(H+)=c(OH-)+c(HSO-4)+2c(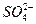 )
)
B.2c (Na+)=c(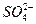 )+c(HSO-4)
)+c(HSO-4)
C.c(Na+)>c(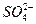 )>c (H+)>c (OH-)
)>c (H+)>c (OH-)
D.c(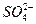 )+c(HSO-4)="0.1" mol·L-1
)+c(HSO-4)="0.1" mol·L-1
参考答案:(1)碱性?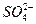 +H2O
+H2O
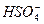 +OH-
+OH-
(2)小于? H2SO4一级电离出H+,对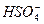 电离起抑制作用,而NaHSO4中不存在抑制作用
电离起抑制作用,而NaHSO4中不存在抑制作用
(3)AD
本题解析:本题以新型信息为前提,考查盐类水解的判断,外界因素对电离平衡的影响以及溶液离子浓度大小关系。由于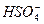 的电离是可逆的,所以
的电离是可逆的,所以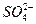 可以发生水解,Na2SO4溶液显碱性。溶液中存在的平衡体系有
可以发生水解,Na2SO4溶液显碱性。溶液中存在的平衡体系有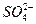 +H2O
+H2O
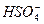 +OH-,H2O
+OH-,H2O H++OH-,溶液中各种离子浓度大小关系为:c(Na+)>c(
H++OH-,溶液中各种离子浓度大小关系为:c(Na+)>c(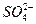 )>c (OH-)>c (
)>c (OH-)>c (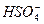 )>c(H+)。电荷守恒关系式:c(Na+)+c(H+)=c(OH-)+c(
)>c(H+)。电荷守恒关系式:c(Na+)+c(H+)=c(OH-)+c(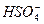 )+2c(
)+2c(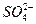 )。物料守恒关系式:c(
)。物料守恒关系式:c(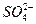 )+c(
)+c(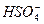 )="0.1" mol·L-1或c(Na+)=2c(
)="0.1" mol·L-1或c(Na+)=2c(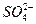 )+2c(
)+2c(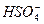 )。
)。
本题难度:简单
5、选择题 已知某溶液中只存在OH-、H+、Na+、CH3COO-四种离子,若该溶液中含有两种溶质,则这四种离子浓度大小顺序可能是(?)
①c(CH3COO-)>c(Na+)>c(OH-)>c(H+)?②c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
③c(Na+)=c(CH3COO-)>c(OH-)=c(H+)?④c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
A.①②
B.①③
C.②④
D.③④
参考答案:D
本题解析:①不可能,c(CH3COO-)>c(Na+),c(OH-)>c(H+) 溶液就会带负电了。
②不可能,c(Na+)>c(CH3COO-),c(H+)>c(OH-),溶液就会带正电了
③可能,CH3COONa和CH3COOH的混合液,显中性即可。
④可能,NaOH和CH3COONa的混合液,NaOH比CH3COONa物质的量多即可
本题难度:简单