1、选择题 2011年为国际化学年,主题为“化学-我们的生活,我们的未来”.?下列说法错误的是( )
A.化学是一门以实验为基础的自然科学
B.化学是在原子、分子水平上研究物质的科学
C.绿色化学的核心是应用化学原理对环境污染进行治理
D.化学是生命科学、材料科学、能源科学等的重要基础
参考答案:C
本题解析:
本题难度:简单
2、填空题 .(21分)合成氨工业对国民经济和社会发展具有重要的意义。其原理为:
N2(g)+3H2(g)  ?2NH3(g)?△H= -92.4KJ/mol?,据此回答以下问题:
?2NH3(g)?△H= -92.4KJ/mol?,据此回答以下问题:
(1)下列有关该反应速率的叙述,正确的是(选填序号)?。
a.升高温度可以增大活化分子百分数,加快反应速率
b.增大压强不能增大活化分子百分数,所以不可以加快反应速率
c.使用催化剂可以使反应的活化能降低,加快反应速率
d.活化分子间所发生的碰撞为有效碰撞
e.降低温度,V正、V逆均减小且V正减小的倍数小于V逆减小的倍数。
f.在质量一定的情况下,催化剂颗粒的表面积大小,对反应速率有显著影响
(2)①该反应的化学平衡常数表达式为K=_______________________。
②根据温度对化学平衡影响规律知,对于该反应,温度越高,其平衡常数的值越_____ 。
(3)某温度下,若把10 mol N2与30 mol H2置于体积为10 L的密闭容器内,反应达到平衡状态时,测得平衡混合气体中氨的体积分数为20%,则该温度下反应的K=___________(可用分数表示)。能说明该反应达到化学平衡状态的是?(填字母)。
a.容器内的密度保持不变?
b.容器内压强保持不变?
c.υ正(N2)=2υ逆(NH3)?
d.混合气体中c(NH3)不变
e.容器内混合气体的平均摩尔质量保持不变
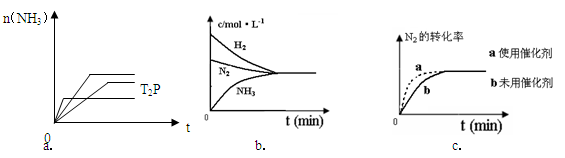
(4)对于合成氨反应而言,下列有关图象一定正确的是(选填序号)_____________。
 (5)相同温度下,有恒容密闭容器A和恒压密闭容器B,两容器中均充入1mol N2和3 molH2,此时两容器的体积相等。在一定条件下反应达到平衡状态,A中NH3的体积分数为a,放出热量Q1 kJ;B中NH3的体积分数为b,放出热量Q2 kJ。则:a_____b(填>、=、<), Q1_____ Q2(填>、=、<), Q1_____92.4(填>、=、<)。
(5)相同温度下,有恒容密闭容器A和恒压密闭容器B,两容器中均充入1mol N2和3 molH2,此时两容器的体积相等。在一定条件下反应达到平衡状态,A中NH3的体积分数为a,放出热量Q1 kJ;B中NH3的体积分数为b,放出热量Q2 kJ。则:a_____b(填>、=、<), Q1_____ Q2(填>、=、<), Q1_____92.4(填>、=、<)。
参考答案:(1)a、c、f、e、?(4分)
(2)①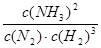 ?(2分)?②小? (2分)
?(2分)?②小? (2分)
(3)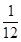 ?(2分)?;b、d 、e(全对3分,选对1个给1分,错选0分)
?(2分)?;b、d 、e(全对3分,选对1个给1分,错选0分)
(4)ac? ………(2分)(5) a<b? Q1<Q2? Q1< 92.4?(各2分)
本题解析:(1)增大压强能增大单位体积内活化分子百分数,所以能增大反应速率,b不正确。活化分子间所发生的碰撞不一定都是有效碰撞,把能够发生化学变化的碰撞称为有些碰撞,d不正确,其余都是正确的,答案选acef。
(2)①平衡常数是在一定条件下,可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度幂之积的比值,所以表达式为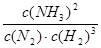 。
。
②正反应是放热反应,升高温度,平衡向逆反应方向移动,平衡常数减小。
(3)? N2(g)+3H2(g)  ?2NH3(g)
?2NH3(g)
起始量(mol)? 10? 30? 0
转化量(mol)? x? 3x? 2x
平衡量(mol)? 10-x? 30-3x? 2x
所以有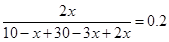
解得x=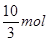
所以平衡常数为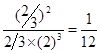
在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态,所以D正确。密度是混合气的质量和容器容积的比值,在反应过程中质量和容积始终是不变的,a不正确。反应是体积减小的,所以压强也是减小的,b正确。C中反应速率的方向相反,但不满足速率之比是相应的化学计量数之比,不正确。混合气的平均相对分子质量是混合气的质量和混合气的总的物质的量的比值,质量不变,但物质的量是变化的,所以d可以说明。答案选bde。
当反应平衡时,物质的浓度不一定是相等的,b不正确。催化剂不能改变平衡状态,所以c正确,温度越高,压强越大,达到平衡的时间就越少,a正确,答案选ac。
(5)因为反应是体积减小的,所以压强也是减小,即B中压强高于A中的,所以B中反应物的转化率高,放出的热量也多,氨气的含量也高。但反应是可逆反应,所以转化率得不到100%,因此不可能92.4kJ热量。
本题难度:一般
3、选择题 温度、催化剂不变,向某一固定体积的容器内按下列各组物质的量加入 反应达平衡时,氨气浓度最大的一组是(?)
反应达平衡时,氨气浓度最大的一组是(?)
?
| 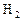
| 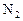
| 
|
A
| 6
| 2
| 0
|
B
| 1
| 0
| 4
|
C
| 3.5
| 1
| 2
|
D
| 5
| 1.5
| 1
参考答案:B
本题解析:略
本题难度:简单
4、选择题 有关接触法制硫酸的叙述,来源:91考试网 91Exam.org其中正确的是…( )
A.用硫或黄铁矿均可作为原料
B.尾气含二氧化硫,进入接触室以前不需再净化处理
C.送进沸腾炉的矿石不需粉碎,燃烧黄铁矿应不断添加燃料
D.接触室中的热交换器的作用是冷却沸腾炉出来的炉气
参考答案:A
本题解析:接触法制硫酸,关键是将SO2与O2通过催化剂(V2O5)的作用,接触氧化为SO3,至于获得SO2,可以将硫燃烧而得,也可以燃烧黄铁矿(主要成分FeS2)而得,所以A说法正确。尾气中含有SO2,但其含量极少,在实际生产中没有价值再送入接触室去氧化,一般作回收处理。块状矿石不易燃烧,故必须粉碎,从化工生产原理上讲叫做增大反应物接触面积,有利于加快化学反应速率。另外黄铁矿燃烧过程是放热的,所以点燃以后不需添加燃料。接触室中的热交换器的作用是加热进入接触室的SO2和O2混合气体,同时冷却反应后生成的SO3气体。
本题难度:简单
5、填空题 (14分)?硫酸是工业生产中一种重要的化工产品,我国工业生产硫酸的主要方法是接触法,主要原料为黄铁矿,请回答下列问题:
(1)已知煅烧黄铁矿的化学方程式为?4FeS2 + 11O2
该反应中氧化剂和氧化产物之比为?;标准状态下得到4.48升SO2 时,一共转移了?mol e-。(每空3分)
(2)已知温度、压强对SO2平衡转化率的影响如下表所示:根据上表回答,SO2转化到SO3的
最佳反应条件是?。(每空2分)
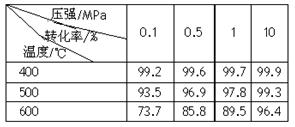
A.400-500℃ 0.1 MPa
B.400℃10 MPa
C.500℃10 MPa
D.400-500℃1 MPa
|
(3)在一定条件下,1mol SO2完全转化成SO3气体时放出热量为Q1 KJ,写出该反应的热化学方程式:?。若在该条件下将2 mol SO2放入一定容积的密闭容器中,一段时间后测得反应放出热量为Q2 KJ,则此时SO2的转化率为??(用含Q1、Q2代数式表示)。(每空2分)
(4)市售浓硫酸的密度是1.84 g / cm3、质量分数为98 % ,若用H2SO4· XH2O来表示这种浓硫酸,则X为??。(每空2分)
参考答案:(14分)
(1)11:10? 1.1? mol e-。(每空3分)?(2)B(2分)
(3)SO2(g)+1/2O2(g) ="=?"  ?SO3(g)?△H="-QKJ/mol?" Q2/2Q1?。(每空2分)
?SO3(g)?△H="-QKJ/mol?" Q2/2Q1?。(每空2分)
(4)1/ 9?。(每空2分)
本题解析:略
本题难度:一般