1、计算题 (10分)硝酸是一种重要的 化工原料,工业上生产硝酸的主要过程如下:
化工原料,工业上生产硝酸的主要过程如下:
(1)以N2和H2为原料合成氨气。一定温度下,在密闭容器中充入ImolN2和3molH2发生反应。若容器容积恒定,达到平衡状态时,气体的总物质的量是原来的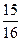 ,则N2的转化率
,则N2的转化率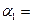 ?;若容器压强恒定,达到平衡状态时,N=的转化率为
?;若容器压强恒定,达到平衡状态时,N=的转化率为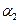 ,则
,则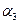 ?
?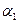 (‘填“>”、“<”或“=”)。
(‘填“>”、“<”或“=”)。
(2)用氨催化氧化法可生产硝酸,其生产过程可表示为:
4NH3+5O2 4NO+6H2O? 4NO+3O2+2H2O=4HNO3
4NO+6H2O? 4NO+3O2+2H2O=4HNO3
现以3.4吨液氨为原料来生产质量分数为50%的硝酸,理论上需要加水的质量为?
吨。(假设生产过程中反应物和生成物均无损耗)
(3)硝酸工业生产中的尾气可用纯碱溶液吸收,有关的化学反应为:
2NO2+Na2CO3=NaNO2+NaNO3+CO2,NO+NO2+Na2CO3=2NaNO2+CO2。若在标准状况下有NO、NO2的混合气体(不考虑N2O4)恰好与50mL 1. 0 mol·L-1的Na2CO3溶液反应完全,且生成NaNO2和NaNO3的物质的量的比为4:1,则在混合气体中NO气体的体积分数为多少?(请写出计算过程)?
0 mol·L-1的Na2CO3溶液反应完全,且生成NaNO2和NaNO3的物质的量的比为4:1,则在混合气体中NO气体的体积分数为多少?(请写出计算过程)?
参考答案:
(1)12.5%或1/8、>(4分,每空2分)?(2)9(3分)
(2)解析:由反应4NH3+5O2
NH3+2O2=HNO3+H2O,3.4吨液氨产生的硝酸为12.6吨,水为3.6吨,则理论上需加水的质量为为:126.t/50%-(12.6+3.6)t=9t
(3)(3分)由反应转化关系知,反应过程中钠元素 守恒,设NaNO2和NaNO3的物质的量分别为4a mol和a mol,则4a+a=50mL×10-3mL·L-1×1.0 mol·L-1×2,解得:a=0.02 mol,于是,推出NO、NO2的物质的量分虽为:0.03 mol、0.07 mol,即:NO所占的体积分数为30%。
守恒,设NaNO2和NaNO3的物质的量分别为4a mol和a mol,则4a+a=50mL×10-3mL·L-1×1.0 mol·L-1×2,解得:a=0.02 mol,于是,推出NO、NO2的物质的量分虽为:0.03 mol、0.07 mol,即:NO所占的体积分数为30%。
本题解析:略
本题难度:简单
2、填空题 (12分)美日科学家因研发“有机合成中的钯催化的交叉偶联”而获得2010年度诺贝尔化学奖。有机合成常用的钯/活性炭催化剂长期使用,催化剂会被杂质(如:铁、有机物等)污染而失去活性,成为废催化剂,故需对其回收再利用。一种由废催化剂制取氯化钯(PdCl2)的工艺流程如下:
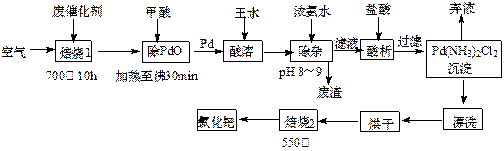
(1)甲酸在反应中的作用是?(选填:“氧化剂”或“还原剂”);
(2)加浓氨水时,钯元素转变为可溶性[Pd(NH3)4]2+,此时铁元素的存在形式是?(写化学式);
(3)王水是浓硝酸与浓盐酸按体积比1∶3混合而成的,钯在王水中溶解的过程中有化合物A和一种无色、有毒气体B生成。
①气体B的化学式为?,
②经测定,化合物A由3种元素组成,有关元素的质量分数为Pd:42.4%,H:0.8%。则A的化学式为?;
(4)700℃“焙烧1”的目的是?,550℃“焙烧2”的目的是?。
参考答案:(12分)
(1)还原剂(2分)?(2)Fe(OH)3(2分)
(3)① NO(1分)?② H2PdCl4(3分)
(4)除去活性炭及有机物( 2分);脱氨[或“将Pd(NH3)2Cl2转变为PdCl2”] (2分)。
2分);脱氨[或“将Pd(NH3)2Cl2转变为PdCl2”] (2分)。
本题解析:略
本题难度:一般
3、选择题 江苏省“十二五”规划指出:“加强生态文明建设,发展循环经济,推广低碳技术,推动绿色增长”。下列做法有悖于生态文明建设的是
[? ]
A.应用高效洁净的能源转换技术,提高能源的利用效率
B.废电池集中填埋
C.多用电子邮件、MSN、QQ等即时通讯工具,少用传真打印机
D.在火电厂推广碳收集和储存技术
参考答案:B
本题解析:
本题难度:简单
4、选择题 下列有关工业生产的叙述正确的是?
A.用明矾净水是因为Al3+水解生成Al(OH)3胶粒具有很强的吸附性
B.合成氨生成过程中,采用高温高压都是为了提高N2、H2转化率
C.硫酸工业中,在接触室安装热交换器是为了利用硫铁矿燃烧时放出的热量
D.电解饱和食盐水制烧碱采用离子交换膜法,可防止阴极室产生的Cl2进入阳极室
参考答案:A
本题解析:略
本题难度:简单
5、选择题 没有采用循环操作的是(?)
A.硫酸工业
B.合成氨工业
C.硝酸工业
D.氯碱工业
参考答案:D
本题解析:硫酸工业中、合成氨工业中、硝酸工业中循环利用的分别是SO2、NO和NO2、N2及H2。
本题难度:简单