1、选择题 下列元素中,最高正化合价数值最大的是
[? ]
A.Na
B.Cl
C.S
D.Si
参考答案:B
本题解析:
本题难度:简单
2、选择题 对于卤族元素的叙述中不正确的是( )
A.沸点HF>HCl>HBr>HI
B.还原性HI>HBr>HCl>HF
C.热稳定性HF>HCl>HBr>HI
D.氧化性F2>Cl2>Br2>I2
参考答案:A、因氢化物的相对分子质量越大,沸点越大,但HF分子中有氢键,沸点最大,则沸点HF>HI>HBr>HCl,故A错误;
B、因非金属性F>Cl>Br>I,则还原性HI>HBr>HCl>HF,故B正确;
C、因非金属性F>Cl>Br>I,则热稳定性HF>HCl>HBr>HI,故C正确;
D、因非金属性F>Cl>Br>I,则氧化性F2>Cl2>Br2>I2,故D正确;
故选A.
本题解析:
本题难度:一般
3、选择题 19世纪中叶,门捷列夫的突出贡献是( )
A.提出原子学说
B.提出分子学说
C.发现元素周期律
D.发现氧气
参考答案:A.道尔顿提出了近代原子学说,故A错误;
B.阿佛加德罗提出了分子学说,故B错误;
C.1869年,俄国化学家门捷列夫发现了元素周期律,故C正确;
D.舍勒发现了氧气,故D错误.
故选C.
本题解析:
本题难度:简单
4、选择题 下列各组物质中,互为同位素的是
[? ]
A.红磷与白磷
B.正丁烷与异丁烷
C.11H与21H
D.金刚石与C60
参考答案:C
本题解析:
本题难度:简单
5、推断题 已知:A、B、C、D、E、F五种元素核电荷数依次增大,属周期表中前四周期的元素。其中A原子核外有三个未成对电子;化合物B2E的晶体为离子晶体,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的熔点在同周期元素形成的单质中是最高的;F原子核外最外层电子数与B相同,其余各层均充满。请根据以上信息,回答下列问题:
⑴A、B、C、D的第一电离能由小到大的顺序为___________。(用元素符号表示)
⑵B的氯化物的熔点比D的氯化物的熔点__________(填高或低),理由是___________。
⑶E的最高价氧化物分子的空间构型是___________。
⑷F的核外电子排布式是___________,F的高价离子与A的简单氢化物形成的配离子的化学式为___________。
⑸A、F形成某种化合物的晶胞结构如图所示,则其化学式为__________;(黑色球表示F原子)?
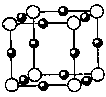
⑹A、C形成的化合物具有高沸点和高硬度,是一种新型无机非金属材料,其晶体中所含的化学键类型为_____________。
参考答案:⑴Na<Al<Si<N
⑵高;NaCl为离子晶体而SiCl4为分子晶体
⑶平面正三角形
⑷1s22s22p63s23p63d104s1(或[Ar]?3d104s1);?[Cu(NH3)4]2+?
⑸Cu3N?
⑹共价键
本题解析:
本题难度:一般