1、选择题 为了使宇航员在飞船中得到一个稳定的、良好的生存环境,一般在飞船内安装盛有Na2O2或K2O2颗粒的装置,它的用途是产生氧气。下列关于Na2O2的叙述正确的是( )。
A.Na2O2中阴、阳离子的个数比为1∶1
B.Na2O2分别与水及CO2反应产生相同量的O2时,需要水和CO2的质量相等
C.Na2O2分别与水及CO2反应产生相同量的O2时,转移电子的物质的量相等
D.Na2O2的漂白原理与SO2的漂白原理相同
参考答案:C
本题解析:Na2O2的电子式为 ,故阴、阳离子的个数比为1∶2,A错误;生成相同量的O2时消耗的水和二氧化碳的物质的量相同,但质量不同,B项错;由得失电子守恒知两者转移电子的物质的量相同,C项正确;Na2O2因具有强氧化性而有漂白性,SO2易与有色物质化合生成不稳定的无色物质,故原理不同,D项错误。
,故阴、阳离子的个数比为1∶2,A错误;生成相同量的O2时消耗的水和二氧化碳的物质的量相同,但质量不同,B项错;由得失电子守恒知两者转移电子的物质的量相同,C项正确;Na2O2因具有强氧化性而有漂白性,SO2易与有色物质化合生成不稳定的无色物质,故原理不同,D项错误。
本题难度:一般
2、选择题 下列物质中,既能与盐酸又能与NaOH溶液反应的是
A.氢氧化铝
B.硅酸钠
C.碳酸钠
D.二氧化硅
参考答案:A
本题解析:分析:根据物质间的反应进行判断,中学常见的既能与酸反应又能与碱反应的物质主要有:
①两性物质:Al2O3、ZnO、Al(OH)3、Zn(OH)2、氨基酸、蛋白质等;
②多元弱酸的酸式盐:NaHCO3、KHS、KHSO3、NaH2PO4等;
③弱酸的铵盐及其酸式盐:(NH4)2S、NH4HS、(NH4)2CO3、NH4HCO3、CH3COONH4等;
④某些具有两性的金属:Zn、Al等;
⑤某些非金属:Si、S等;
⑥其它一些物质.如:a、某些盐类物质既与酸反应,又与碱反应;
b、个别酸性氧化物SiO2;
c、具有还原性的无氧酸:H2S、HI等与氧化性酸反应、与碱反应;
d、具有氧化性酸:浓H2SO4、HNO3等与还原性酸反应、与碱反应,以此解答本题.
解答:A.氢氧化铝是两性氢氧化物,能与盐酸反应生成氯化铝与水,与氢氧化钠反应生成偏铝酸钠与水,故A符合;
B.硅酸钠与盐酸反应生成硅酸与氯化钠,不能与氢氧化钠反应,故B不符合;
C.碳酸钠与盐酸反应生成氯化钠、二氧化碳与水,不能与氢氧化钠反应,故C不符合;
D.二氧化硅与氢氧化钠反应生成硅酸钠与水,不能与盐酸反应,故D不符合;
故选A.
点评:本题考查了物质的性质,难度不大,旨在考查学生对知识的理解识记与知识归纳,明确物质的性质是解本题的关键,注意基础知识的积累.
本题难度:简单
3、选择题 把镁铝合金用稀硫酸溶解,加入氢氧化钠溶液的体积与生成沉
淀的质量关系如右图,则合金中镁和铝的质量比是(?)
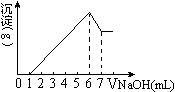
A.1∶1
B.8∶9
C.4∶3
D.4∶9
参考答案:B
本题解析:略
本题难度:简单
4、填空题 (1)镁称为“国防金属”,常用作还原剂和脱氧剂,二氧化碳常被用作灭火剂,但是当把点燃的镁条伸入盛有CO2的集气瓶中时,镁条却能继续燃烧。请写出化学方程式?。
(2)下图变化是工业制硝酸的主要途径NH3→NO→NO2→HNO3请写出NH3→NO的化学方程式?。硝酸生产过程排放出来的NO是大气污染物之一。目前有一种治理方法,是在400℃左右且有催化剂存在的情况下,用氨把NO还原成无色无毒气体直接排放到空气中,化学方程式为?。
参考答案:(1)2Mg+CO2 2MgO+C(2分)
2MgO+C(2分)
(2)4NH3+5O2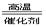 4NO+6H2O(2分)4NH3+6NO
4NO+6H2O(2分)4NH3+6NO 5N2+ 6H2O(2分)
5N2+ 6H2O(2分)
本题解析:略
本题难度:简单
5、选择题 现有一块已知质量的铝镁合金,欲测定其中镁的质量分数,几位同学设计了以下三种不同的实验方案
实验设计1:铝镁合金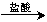 ?测定生成的气体在标准状况下的体积
?测定生成的气体在标准状况下的体积
实验设计2:铝镁合金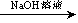 测定生成的气体在标准状况下的体积
测定生成的气体在标准状况下的体积
实验设计3:铝镁合金 溶液
溶液 过滤,测定得到沉淀的质量
过滤,测定得到沉淀的质量
则能测定出镁的质量分数的是(?)
A.都能
B.都不能
C.①不能,其它都能
D.②③不能,①能
参考答案:A
本题解析:实验设计1:有质量及气体的体积,可以计算,故正确;实验设计2:有质量及气体的体积,可以计算,故正确;实验设计3:有质量及气体的体积,可以计算,故正确。故选A。
点评:本题考查的是无机反应和化学计算的知识,分析清楚发生化学反应的原理是解题的关键,题目难度适中。
本题难度:一般