1、填空题 (8分)在0.5L的密闭容器中,一定量的氮气和氢气进行
如下化学反应:N2(g)+3H2(g) 2NH3(g)
2NH3(g)
参考答案:
本题解析:
本题难度:一般
2、选择题 一定条件下,体积为2L的密闭容器中,1mol X和3mol Y进行反应:X(g)+3Y(g)?2Z(g),经12s达到平衡,生成0.6mol Z.下列说法正确的是( )
A.以X浓度变化表示的反应速率为
mol(L?s)
B.12s后将容器体积扩大为10L,Z的平衡浓度变为原来的
C.若增大X的浓度,则物质Y的转化率减小
D.若该反应的△H<0,升高温度,平衡常数K减小
参考答案:一定条件下,体积为2L的密闭容器中,1molX和3molY进行反应:X(g)+3Y(g)?2Z(g),经12s达到平衡,生成0.6molZ.依据化学平衡三段式列式计算为:
? X(g)+3Y(g)?2Z(g)
起始量(mol)? 1? 3? ?0
变化量(mol)?0.3?0.9? ?0.6
平衡量(mol)?0.7? 2.1?0.6
A、以X浓度变化表示的反应速率为0.3mol2L12s=180mol(L?s),故A错误;
B、12s后将容器体积扩大为10L,体积变化Z的浓度变为原来的110,为0.03mol/L,但减小压强平衡逆向进行,Z的平衡浓度小于0.03mol/L,故B错误;
C、若增大X的浓度,则物质Y的转化率增大,故C错误;
D、若该反应的△H<0,升高温度,平衡向吸热反应方向进行,平衡逆向进行,平衡常数K减小,故D正确;
故选D.
本题解析:
本题难度:一般
3、选择题 下列各反应达到化学平衡后,加压或降温都能使化学平衡向逆反应方向移动的是( )
A.C(固)+CO2(气)?2CO(气) (正反应为放热反应)
B.C(固)+CO2(气)?2CO(气) (正反应为吸热反应)
C.N2(气)+3H2(气)?2NH3(气) (正反应为放热反应)
D.H2S(气)?H2(气)+S(固) (正反应为吸热反应)
参考答案:A、正反应是体积减小的反应,增大压强平衡向正反应移动,正反应为放热反应,降低温度平衡向正反应移动,故A不选;
B、正反应为体积增大的反应,增大压强,平衡向逆反应移动,正反应是吸热反应,降低温度平衡向逆反应移动,故B选;
C、正反应为体积减小的反应,增大压强,平衡向正反应移动,正反应是放热反应,降低温度平衡向正反应移动,故C不选;
D、反应前后体积不变,增大压强平衡不移动,正反应是吸热反应,降低温度平衡向逆反应移动,故D不选;
故选B.
本题解析:
本题难度:简单
4、简答题 (本题共12分)
氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:
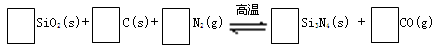
29.配平反应中各物质的化学计量数,并标明电子转移方向和数目。
30.该反应的氧化剂是 ,其还原产物是 。
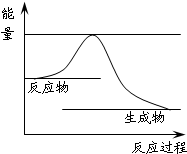
31.上述反应进程中能量变化示意图如下,试在图像中用虚线表示在反应中使用催化剂后能量的变化情况。
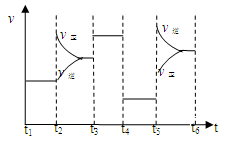
32.该反应的平衡常数表达式为K= 。升高温度,其平衡常数 (选填“增大”、“减小”或“不变”)。
33.该化学反应速率与反应时间的关系如上图所示,t2时引起v正突变、v逆 渐变的原因是
,t3引起变化的因素为 ,t5时引起v逆大变化、v正小变化的原因是 。
参考答案:
 29.
29.
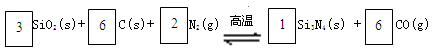
(配平1分,标明电子转移方向和数目共1分)
30. 氮气 氮化硅(化学式同样给分) (2分)
31. 起点、终点与原图像一致(1分),波峰的高度比原图像低(1分)。图示答案略。
32. K=[c(CO)]6/[c(N2)]2 (1分) 减小(1分)
33. 增大了氮气的浓度(1分) 加入(使用)了(正)催化剂(1分)
升高温度或缩小容器体积(2分)
本题解析:30、该反应中碳化合价由0价到+2,氮元素由0价变为-3价,氮气为氧化剂,氮化硅为还原产物;31、催化剂不改变反应能量变化但可以降低反应活化能,即起点、终点与原图像一致,波峰的高度比原图像低;32、由图确定该反应为放热反应,升高温度平衡逆向移动,平衡常数变小;33、t2时图像逆反应速率没变,正反应速率增大应为增加气态反应物浓度,t3时反应速率增大,平衡不移动,(而且方程式化学计量数不等不是压强改变)应该是使用正催化剂;t5时反应速率均增大,且逆反应速率大于正反应速率,应为升高温度或缩小容器体积增大压强。
考点:考查化学平衡有关问题。
本题难度:一般
5、填空题 (10分)⑴请选择合适方法的字母代号填空:
①从海水中提取粗盐________; ② 煤转化为焦炭、煤焦油等________;
③ 工业上由氧化铝制取金属铝________; ④ 提纯氢氧化铁胶体________。
A.过滤 B.裂解 C.分馏 D.裂化 E.干馏 F.还原
G.电解 H.溶解 I.渗析 J.蒸发 K.氧化
⑵某可逆反应从0—2分钟进行过程中, 在不同反应时间各物质的量的变化情况如下图所示。则该反应的的反应物是 ,生成物是 ,此反应 (填是或不是)可逆反应;反应开始至2分钟时, _____ (能或不能)用C表示反应速率,2分钟后A、B、C各物质的量不再随时间的变化而变化,说明在这个条件下,反应已达到了 ____ 状态,此时正反应速率 逆反应速率(填等于或不等于)。
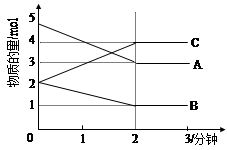
参考答案:(10分)⑴① J ② E ③ G ④ I
⑵ A和B , C , 是 ; 能 , 化学平衡 , 等于 (每空1分)
本题解析:(1)①从海水中提取粗盐,只需蒸发水分即可,选J;②煤转化为焦炭、煤焦油等需要将煤隔绝空气加强热进行干馏,选E;③工业电解氧化铝冶炼铝,选G;④提取交替用渗析的方法,选I;
(2)根据图像判断,物质的量减少的是反应物,增加的是生成物,所以A、B是反应物,C是生成物;一段时间后反应物、生成物的物质的量不再改变,所以该反应是可逆反应;反应开始至2分钟时,C的物质的量增加,可以用C表示反应速率;2分钟后A、B、C各物质的量不再随时间的变化而变化,说明在这个条件下,反应已达到了化学平衡状态,此时正反应速率等于逆反应速率。
考点:考查物质的分离和提纯方法的判断,化学平衡、反应速率的判断
本题难度:一般