1、选择题 下列离子方程式的书写与所给条件相符的是
A.将4 molCl2通入到含有4 mol FeBr2的溶液中:2Cl2+2Fe2++2Br-= 4Cl-+Br2+2Fe3+
B.已知亚硫酸(H2SO3)的第二级电离常数K2比偏铝酸(HAlO2)的电离常数K要大,则将少量的SO2气体通入到偏铝酸钠溶液中发生的离子反应是:AlO2-+ SO2+2 H2O =Al(OH)3↓+HSO3-
C.稀氨水溶液吸收了少量二氧化碳气体: NH3 ·H2O + CO2 = NH4+ + HCO3-
D.在明矾溶液中加入氢氧化钡溶液至沉淀质量达到最大时发生的离子反应是: 2Al3+ +3SO42-+3Ba2++6OH-= 3BaSO4↓+2 Al(OH)3↓
参考答案:A
本题解析:A.根据电子守恒,将4 molCl2共得到8mol电子,先和二价铁离子反应,4 mol Fe2+得到4mol电子,还有4molBr-得到电子生成了2molBr2分子,FeBr2的溶液中:2Cl2+2Fe2++2Br-= 4Cl-+Br2+2Fe3+,故正确;B.亚硫酸(H2SO3)的二级电离常数K2比偏铝酸(HAlO2)要大,说明酸性:亚硫酸氢根离子>偏铝酸,则亚硫酸氢根离子也能和偏铝酸钠溶液,所以将少量的SO2气体通入到偏铝酸钠溶液中发生的反应为2AlO2-+SO2+3H2O=2Al(OH)3↓+SO32-,不符合强酸制弱酸的原则,故B错误。C.稀氨水溶液吸收了少量二氧化碳气体应该生成碳酸铵,错误;D.在明矾溶液中加入氢氧化钡溶液至沉淀质量达到最大时只要保证两个物质的量之比是2:3时可达到沉淀量最大,即发生的离子反应是: 3Ba2+ + 3SO42- +2Al3+ + 6OH- ="==2" Al(OH)3↓+3BaSO4
本题难度:一般
2、选择题 下列水解的离子方程式正确的是
A.NH4++H2O NH3·H2O+H+
NH3·H2O+H+
B.Br-+H2O HBr+OH-
HBr+OH-
C.CO32-+2H2O H2CO3+2OH-
H2CO3+2OH-
D.Fe3++3H2O Fe(OH)3↓+3H+
Fe(OH)3↓+3H+
参考答案:A
本题解析:NH4++H2O NH3·H2O+H+表示的是铵根离子水解的离子方程式,故A正确,为本题的答案;氢溴酸为强酸,所以溴离子不会发生水解,故B错误;碳酸根离子的水解应该分为两步,故C错误;盐类水解一般很微弱,产物不标“↓”,故D错误。
NH3·H2O+H+表示的是铵根离子水解的离子方程式,故A正确,为本题的答案;氢溴酸为强酸,所以溴离子不会发生水解,故B错误;碳酸根离子的水解应该分为两步,故C错误;盐类水解一般很微弱,产物不标“↓”,故D错误。
点评:本题考查了物质的水解,属于对基础知识的考查,本题要注意的是强酸的酸根离子是不会发生水解的,多元弱酸根离子是分步进行的,盐类水解一般很微弱,产物不标“↓”,本题难度中等。
本题难度:简单
3、简答题 已知A、B、C、D两种短周期元素,分别属于不同的主族,其原子序数依次增大,其中A与D、B与C的原子的最外层电子数之和均为9,A原子的最外层与次外层电子数相等,A、B、C、D中只有两种金属元素.试回答下列问题:
(1)A的元素符号为______,C的氢化物的化学式为______.
(2)为比较C与D的单质的氧化性强弱,可设计实验以证实,则该实验所依据的反应的化学方程式为______.
(3)1molC的氢化物与足量C的氧化物反应,转移的电子的物质的量为______mol.
(4)已知E、G、F是均含有B元素的化合物,其有关转化关系如图,请写出E与F反应生成G的离子方程式______.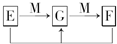
参考答案:(1)A原子的最外层与次外层电子数相等可知A为Be.A与D最外层电子数之和为9,可知D最外层7个电子,且分别属于不同的主族,D为Cl.和为9,且A、B、C、D中只有两种金属元素,可知B最外层3个电子,B为Al.C为S.C的氢化物的化学式为H2S.
(2)氧化性:Cl2>S,根据氧化性:氧化剂>氧化产物,则有H2S+Cl2═S↓+2HCl.
当含有变价元素的还原剂在相似的条件下作用于不同的氧化剂时,可根据氧化产物价态的高低来判断氧化剂氧化性强弱.如:Fe+S?△?.?FeS,2Fe+3Cl2?△?.?2FeCl3
(3)SO2+2H2S=3S↓+2H2O,1mol二氧化硫得到4mol电子,1mol硫化氢失2mol电子.
(4)B为Al,常见存在形式为AlO2-,Al(OH)3,Al3+,
故答案为:(1)Be H2S
(2)Fe+S?△?.?FeS,2Fe+3Cl2?△?.?2FeCl3(或H2S+Cl2═S↓+2HCl)
(3)2
(4)Al3++3AlO2-+6H2O═4Al(OH)3
本题解析:
本题难度:一般
4、选择题 下列离子方程式书写正确的是( )
A.石灰石溶于盐酸:CO32-+2H+═H2O+CO2↑
B.Al2O3粉末溶于NaOH溶液中:Al2O3+2OH-=2AlO2-+H2O
C.硫酸氢钠溶液与氢氧化钡溶液的反应:Ba2++SO42-=BaSO4↓
D.氧化钠加入盐酸中:O2-+2H+═H2O
参考答案:A.石灰石溶于盐酸的离子反应为CaCO3+2H+═H2O+CO2↑+Ca2+,故A错误;
B.Al2O3粉末溶于NaOH溶液中的离子反应为Al2O3+2OH-=2AlO2-+H2O,故B正确;
C.硫酸氢钠溶液与氢氧化钡溶液的反应,若硫酸氢钠少量时的离子反应为:H++OH-+Ba2++SO42-=BaSO4↓+H2O,故C错误;
D.氧化钠加入盐酸中的离子反应为Na2O+2H+═H2O+2Na+,故D错误;
故选B.
本题解析:
本题难度:简单
5、选择题 能正确表示下列化学变化的离子方程式是
A.碳酸钙与盐酸反应 CO32 -+ 2 H+ = CO2↑+ H2O
B.金属铁放入稀盐酸中 Fe + 2H+ = Fe2+ + H2↑
C.氯化亚铁溶液中通入氯气 Fe2+ + Cl2 = Fe3+ + 2Cl-
D.二氧化锰与浓盐酸反应 MnO2 + 4HCl = Mn2+ ?+ 2Cl- + Cl2↑+2H2O
参考答案:B
本题解析:A错,碳酸钙难溶于水,不能拆成离子形式;B正确;C错,电荷未守恒;D错,HCL要拆成离子形式;
本题难度:一般