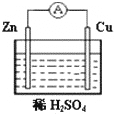
1、简答题 原电池是一种将______能转化为______能的装置.右图所示的原电池装置中,锌片发生______(填“氧化”或“还原”)反应.铜片上能够观察到的现象是______,该电极反应式是______.
2、填空题 (8分)被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高效率的特点.下图为氢氧燃料电池的结构示意图,
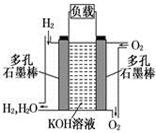
电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒.当氧气和氢气分别连续不断地从正、负两极通入燃料电池时,便可在闭合回路中不断地产生电流.试回答下列问题:
(1) 写出氢氧燃料电池工作时正极电极反应方程式: ___________?。
(2)如果该氢氧燃料电池每转移0.1mol电子,消耗标准状况下___________L氧气。?
(3) 若将此燃料电池改进为直接以甲烷和氧气为原料进行工作时,负极反应式为___________________。?电池总离子反应方程式为_______________________________。
3、填空题 (I)将Zn棒和Cu棒用导线连接后,放入某电解质溶液中,构成如图所示装置。试回答下列问题:
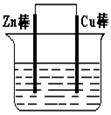
(1)若电解质溶液为稀硫酸,则Zn棒为原电池的?极,可观察到Cu棒上产生现象是?,试用电极反应式表示该现象:?。
(2)若电解质为硫酸铜溶液,则Cu棒上发生?反应(填“氧化”“还原”),Zn棒上发生反应的电极反应式为:?。
(3)若在上述两个过程中,Zn棒减少的质量相等,则Cu棒上(1)和(2)所析出物质的质量之比为:?。
(II)A、B、C三个烧杯中分别盛有500mL相同物质的量浓度的稀硫酸
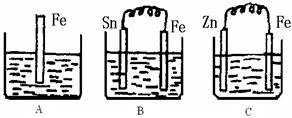
(1)写出A中离子反应方程式:?
(2)一段时间后,B中Sn极附近溶液的pH?(填“增大”、“减小”、“不变”)。
(3)一段时间后,C中产生了5.6L(标准状况)气体时,硫酸恰好全部被消耗,则原稀硫酸溶液的物质的量浓度为?
(4)反应完成后三个烧杯中液体质量大小顺序为:A?B?C (用<、=、>连接)。
4、选择题 若某电能与化学能的转化装置(电解池或原电池)中发生的总反应的离子方程式是Cu+2H+═Cu?2++H2↑,则下列关于该装置的有关说法正确的是( )
A.该装置可能是原电池,也可能是电解池
B.该装置只能是原电池,且电解质溶液为硝酸
C.该装置只能是电解池,电解质溶液是硫酸铜
D.该装置只能是电解池,且金属铜为该电解池的阳极
5、填空题 甲醇是一种可再生能源,具有广泛的开发和应用前景。工业上常用CO和H2反应生产CH3OH,并开发出甲醇燃料电池。
(1)已知:CO(g)+1/2O2(g)=CO2(g)?△H=-283.0?kJ·mol-1?
2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l)?△H=-1453.0?kJ·mol-1
则CH3OH(l)不完全燃烧生成CO(g)和H2O(l)的热化学方程式为_____________。
(2)工业上常利用反应CO(g)+2H2(g)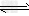 CH3OH(g)?△H<0合成甲醇,在230℃~270℃最为有利。为研究合成气最合适的起始组成比,分别在230℃、250℃和270℃进行实验,结果如图
CH3OH(g)?△H<0合成甲醇,在230℃~270℃最为有利。为研究合成气最合适的起始组成比,分别在230℃、250℃和270℃进行实验,结果如图
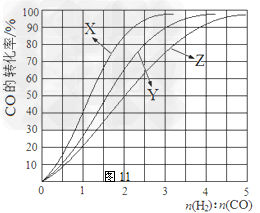
230℃的实验结果所对应的曲线是? (填字母); 该温度下工业生产适宜采用的合成气组成n(H2):n(CO) 的比值范围是? (填字母) 。
A.1~1.5?B.2.5~3? C.3.5~4.5
(3)制甲醇所需要的氢气,可用下列反应制取:H2O(g)+CO(g) H2(g)+CO2(g) △H<0,某温度下该反应的平衡常数K=1。试回答下列问题:
H2(g)+CO2(g) △H<0,某温度下该反应的平衡常数K=1。试回答下列问题:
①该温度下,若起始时c(CO)=1?mol·L-1,c(H2O)=2?mol·L-1,反应进行一段时间后,测得H2的浓度为0.5?mol·L-1,则此时该反应v(正)?_________v(逆)(填“> ”、“<”或“=”)。
②若降低温度,该反应的K值将__________(填“增大”、“减?小”或“不变”)。
(4)某实验小组设计了如图所示的甲醇燃料电池装置。?

①该电池工作时,OH-向________极移动(填“a”或“b”)。
②工作一段时间后,测得溶液的pH减小,该电池负极反应式为_________,?电池总反应的离子方程式为_______________。