1、简答题 原电池是一种将______能转化为______能的装置.右图所示的原电池装置中,锌片发生______(填“氧化”或“还原”)反应.铜片上能够观察到的现象是______,该电极反应式是______.
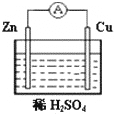
参考答案:原电池是一种将化学能转变为电能的装置,图中的Cu、Zn原电池中,Zn失去电子作负极,被氧化,发生氧化反应,
正极上氢离子得到电子生成氢气,电极反应为2H++2e-=H2↑,所以观察到正极上有无色气泡生成,
故答案为:化学;电;氧化;有无色气泡生成;2H++2e-=H2↑.
本题解析:
本题难度:一般
2、填空题 (8分)被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高效率的特点.下图为氢氧燃料电池的结构示意图,
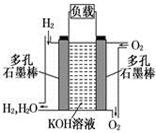
电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒.当氧气和氢气分别连续不断地从正、负两极通入燃料电池时,便可在闭合回路中不断地产生电流.试回答下列问题:
(1) 写出氢氧燃料电池工作时正极电极反应方程式: ___________?。
(2)如果该氢氧燃料电池每转移0.1mol电子,消耗标准状况下___________L氧气。?
(3) 若将此燃料电池改进为直接以甲烷和氧气为原料进行工作时,负极反应式为___________________。?电池总离子反应方程式为_______________________________。
参考答案:(1)2H2O+O2+4e-=4OH-;?(2)0.56L;
(3)CH4+10OH--8e-=CO32-+7H2O; CH4+2O2+2OH-=CO32-+3H2O
本题解析:(1)在氢氧燃料电池中,通入氢气的电极是负极,通入氧气的电极是正极,工作时正极电极反应方程式:2H2O+O2+4e-=4OH-;(2)在整个闭合回路中电子转移数目相等。由于每mol的氧气反应时得到电子4mol.n(e-)=0.1mol。所以n(O2)=0.025mol.在标准状况下其体积为0.025mol.× 22.4L/mol= 0.56L;(3) 若将此燃料电池改进为直接以甲烷和氧气为原料进行工作时,则通入甲烷的电极为负极,负极反应式为CH4+10OH--8e-=CO32-+7H2O;正极的电极反应式是:2H2O+O2+4e-=4OH-电池总离子反应方程式为CH4+2O2+2OH-=CO32-+3H2O。
本题难度:一般
3、填空题 (I)将Zn棒和Cu棒用导线连接后,放入某电解质溶液中,构成如图所示装置。试回答下列问题:
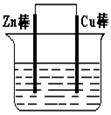
(1)若电解质溶液为稀硫酸,则Zn棒为原电池的?极,可观察到Cu棒上产生现象是?,试用电极反应式表示该现象:?。
(2)若电解质为硫酸铜溶液,则Cu棒上发生?反应(填“氧化”“还原”),Zn棒上发生反应的电极反应式为:?。
(3)若在上述两个过程中,Zn棒减少的质量相等,则Cu棒上(1)和(2)所析出物质的质量之比为:?。
(II)A、B、C三个烧杯中分别盛有500mL相同物质的量浓度的稀硫酸
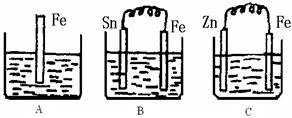
(1)写出A中离子反应方程式:?
(2)一段时间后,B中Sn极附近溶液的pH?(填“增大”、“减小”、“不变”)。
(3)一段时间后,C中产生了5.6L(标准状况)气体时,硫酸恰好全部被消耗,则原稀硫酸溶液的物质的量浓度为?
(4)反应完成后三个烧杯中液体质量大小顺序为:A?B?C (用<、=、>连接)。
参考答案:(I)(1)负极(1分)有无色气泡析出(1分) 2H++2e-=H2↑(2分)
(2)还原(1分) Zn-2e-=Zn2+(2分)
(3)1:32(2分)
(II)(1)Fe+2H+=Fe2++H2↑ (2分)
(2)增大?(1分)
(3)0.5mol·L-1(2分)?
(4)=、<(每空1分)
本题解析:(I)(1)Zn+CuSO4=ZnSO4+Cu↑
负极:Zn-2e-=Zn2+?正极:2H++2e-=H2↑
(2)Zn+H2SO4=ZnSO4+H2↑
负极:Zn-2e-=Zn2+?正极:Cu2++2e-=Cu↑
(3)H2?~? Zn? ~? Cu可知。
(II)B中铁为负极,Sn为正极,2H++2e-=H2↑, pH增大。
C中锌为负极:Zn+H2SO4=ZnSO4+H2↑可求得:
0.25mol? 5.6L
c(H2SO4)=0.5mol·L-1
(4)A、B中均发生反应:Fe+H2SO4=FeSO4+H2↑;C中为::Zn+H2SO4=ZnSO4+H2↑
比较可知:A、B硫酸中增加1molFe,析出1molH2,质量增加54g;而C中硫酸中增加1molZn,析出1molH2,质量增加63g;
本题难度:一般
4、选择题 若某电能与化学能的转化装置(电解池或原电池)中发生的总反应的离子方程式是Cu+2H+═Cu?2++H2↑,则下列关于该装置的有关说法正确的是( )
A.该装置可能是原电池,也可能是电解池
B.该装置只能是原电池,且电解质溶液为硝酸
C.该装置只能是电解池,电解质溶液是硫酸铜
D.该装置只能是电解池,且金属铜为该电解池的阳极
参考答案:铜和盐酸或稀硫酸不能自发的进行氧化还原反应,铜和硝酸能自发的进行氧化还原反应,但生成的气体是氮氧化物而不是氢气,所以该反应只能是电解池反应而不是原电池反应,所以该装置只能构成电解池不能构成原电池;
该电解池中,阳极上铜失电子发生氧化反应,阴极上氢离子得电子发生还原反应,所以该电解池的阳极必须是铜电极,故选D.
本题解析:
本题难度:一般
5、填空题 甲醇是一种可再生能源,具有广泛的开发和应用前景。工业上常用CO和H2反应生产CH3OH,并开发出甲醇燃料电池。
(1)已知:CO(g)+1/2O2(g)=CO2(g)?△H=-283.0?kJ·mol-1?
2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l)?△H=-1453.0?kJ·mol-1
则CH3OH(l)不完全燃烧生成CO(g)和H2O(l)的热化学方程式为_____________。
(2)工业上常利用反应CO(g)+2H2(g) CH3OH(g)?△H<0合成甲醇,在230℃~270℃最为有利。为研究合成气最合适的起始组成比,分别在230℃、250℃和270℃进行实验,结果如图
CH3OH(g)?△H<0合成甲醇,在230℃~270℃最为有利。为研究合成气最合适的起始组成比,分别在230℃、250℃和270℃进行实验,结果如图
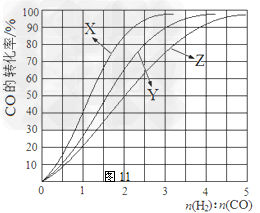
230℃的实验结果所对应的曲线是? (填字母); 该温度下工业生产适宜采用的合成气组成n(H2):n(CO) 的比值范围是? (填字母) 。
A.1~1.5?B.2.5~3? C.3.5~4.5
(3)制甲醇所需要的氢气,可用下列反应制取:H2O(g)+CO(g) H2(g)+CO2(g) △H<0,某温度下该反应的平衡常数K=1。试回答下列问题:
H2(g)+CO2(g) △H<0,某温度下该反应的平衡常数K=1。试回答下列问题:
①该温度下,若起始时c(CO)=1?mol·L-1,c(H2O)=2?mol·L-1,反应进行一段时间后,测得H2的浓度为0.5?mol·L-1,则此时该反应v(正)?_________v(逆)(填“> ”、“<”或“=”)。
②若降低温度,该反应的K值将__________(填“增大”、“减?小”或“不变”)。
(4)某实验小组设计了如图所示的甲醇燃料电池装置。?

①该电池工作时,OH-向________极移动(填“a”或“b”)。
②工作一段时间后,测得溶液的pH减小,该电池负极反应式为_________,?电池总反应的离子方程式为_______________。
参考答案:(1)CH3OH(l)+O2(g)=CO(g)+2H2O(l)?△H?=-443.5kJ·mol-1
(2)X?;?B
(3)①?>?;?②增大
(4)①?b? ;②?CH3OH?-?6e-+?8OH-=CO32-?+?6H2O? ;2CH3OH?+?3O2?+?4OH-=2CO32-?+?6H2O
本题解析:
本题难度:一般