1、填空题 (10分)在一个固定体积的密闭容器中,保持一定温度,进行以下反应:H2(g)+Br2(g)  2HBr(g)。已知加入1 mol H2和2 mol Br2时,达到平衡后生成a mol HBr(见下表的“已知”项),在相同条件下,且保持平衡时各组分的含量不变,对下列编号(1)~(3)的状态,填写表中的空白。
2HBr(g)。已知加入1 mol H2和2 mol Br2时,达到平衡后生成a mol HBr(见下表的“已知”项),在相同条件下,且保持平衡时各组分的含量不变,对下列编号(1)~(3)的状态,填写表中的空白。
编号
| 起始状态(mol)
| 平衡时HBr(g)
物质的量(mol)
|
H2
| Br2
| HBr
|
已知
| 1
| 2
| 0
| a
|
(1)
| 2
| 4
| 0
| ?
|
(2)
| ?
| ?
| 1
| 0.5 a
|
(3)
| m
| n(n≥2m)
| ?
| ?
|
?
参考答案:(1)2a? (2)0? 0.5?(3)2(n-2m)? a(n-m)
本题解析:等温、等容下的“等效平衡”
H2(g)+Br2(g)  2HBr(g)(因反应前后,气体系数相等,则压强不影响该平衡移动)
2HBr(g)(因反应前后,气体系数相等,则压强不影响该平衡移动)
已知? 1? 2? 0
(1)? 2? 4? 0 ,相当于两个已知,则平衡时n(HBr)="2a" mol;
(2)平衡时n(HBr)="0.5a" mol,
也与已知比,则起始态可以依次是0.5? 1? 0,或相当于0? 0.5? 1;
(3)设依次为:x、y
(m+0.5x)∶(n+0.5x)∶y=1∶2∶a,得:x=2(n-2m),y=(n-m)a。
本题难度:一般
2、选择题 在合成氨反应中,下列反应物与生成物之间的反应速率关系,正确的是( )
A.v(H2)=
v(NH3)
B.v(H2)=v(NH3)
C.v(N2)=v(NH3)
D.v(N2)=2v(NH3)
参考答案:合成氨的反应为3H2+N2高温高压
本题解析:
本题难度:简单
3、选择题 某温度下,将2 mol A和3 mol B充入一密闭的容器中,发生反应:
xA(g)+B(g)  C(g)+D(g),5 min后达到平衡。已知各物质的平衡浓度关系为
C(g)+D(g),5 min后达到平衡。已知各物质的平衡浓度关系为
cx(A)·c(B)=c(C)·c(D),若在温度不变的情况下将容器的体积扩大为原来的10倍,
A的转化率不发生变化,则B的转化率为(?)
A. 40%?B. 60%?C. 24%?D. 4%
参考答案:A
本题解析:在温度不变的情况下将容器的体积扩大为原来的10倍,A的转化率不发生变化,说明了压强的变化并不会影响该反应,所以该反应是反应前后分子数变的反应,故x为1,所以该反应为A(g)+B(g)  C(g)+D(g),根据平衡常数K=c(A)·c(B)/(c(C)·c(D))=1,设该容器为1L,则反应的物质的量为a,则可以得到,(2-a)(3-a)/(a×a)=1,解答a=1.2,所以B的转化率="1.2/3=" 40% ,故本题的答案选择A。
C(g)+D(g),根据平衡常数K=c(A)·c(B)/(c(C)·c(D))=1,设该容器为1L,则反应的物质的量为a,则可以得到,(2-a)(3-a)/(a×a)=1,解答a=1.2,所以B的转化率="1.2/3=" 40% ,故本题的答案选择A。
点评:本题考查了转化率的计算,该考点是高考常考的考点,本题要抓住的是在温度不变的情况下将容器的体积扩大为原来的10倍,A的转化率不发生变化,说明了压强的变化并不会影响该反应,所以该反应是反应前后分子数变的反应,故x为1,然后根据K进行计算,该题难度中等。
本题难度:一般
4、选择题 在一定条件下,测得2CO2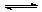 2CO+O2(反应从CO2开始)平衡体系的平均相对分子质量为M,在此条件下,CO2的分解率为?(?)
2CO+O2(反应从CO2开始)平衡体系的平均相对分子质量为M,在此条件下,CO2的分解率为?(?)
A.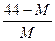 ? B.
? B.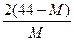 ? c.
? c.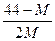 ? D.
? D.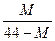
参考答案:B
本题解析:略
本题难度:简单
5、选择题 将0.6molA和0.5molB充入0.4L密闭容器中发生反应:2A(g)+B(g)?mD(g)+E(g),经过5min后达到化学平衡,此时测得D为0.2mol.又知5min内用E表示的平均反应速率为0.1mol?L-1?min-1,下列结论正确的是( )
A.B的转化率为20%
B.m值为1
C.5min内用A表示的平均反应速率为0.1mol?L-1?min-1
D.平衡时反应混合物总物质的量为1mol
参考答案:5min内用E表示的平均反应速率为0.1mol?L-1?min-1,依据反应速率计算反应消耗的物质的量=0.1mol?L-1?min-1 ×0.4L×5min=0.2mol;
2A(g)+B(g)?mD(g)+E(g)
起始量(mol)0.60.5 0 0
变化量(mol) 0.40.2 0.20.2
平衡量(mol) 0.2 0.3 0.2 0.2
A、B的转化率=0.2mol0.5mol×100%=40%,故A错误;
B、依据消耗量分析可知m=1,故B正确;
C、5min内用A表示的平均反应速率=0.4mol0.4L5min=0.2mol/L?min,故C错误;
D、平衡时反应混合物总物质的量=0.2+0.3+0.2+0.2=0.9mol,故D错误;
故选B.
本题解析:
本题难度:一般