1、填空题 某化学小组采用如图装置,以冰醋酸和异戊醇制备少量乙酸异戊酯(俗称:香蕉水)。
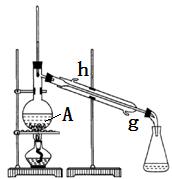
已知:CH3COOH+HOCH2CH2CH(CH3)2? CH3COOCH2CH2CH(CH3)2+H2O
CH3COOCH2CH2CH(CH3)2+H2O
?
| 密度(g/m L) L)
| 熔点(℃)
| 沸点(℃)
| 溶解性
|
冰醋酸
| 1.049
| 16.6
| 118.1
| 能溶于水
|
异戊醇
| 0.812
| -117.2℃
| 130.5
| 微溶于水
|
乙酸异戊酯
| 0.869
| -78℃
| 140
| 难溶于水
|
实验步骤:
(1)制备粗品
在50mL干燥的?中(填仪器名称)加入10mL(8.1g , 0.092mol)异戊醇和10mL(10.5g , 0.175mol)冰醋酸,振摇下缓缓加入2.5mL浓硫酸并使其混合均匀,再投入几块碎瓷片,装上冷凝管,冷却水从_________口进入,控制温度100℃左右,加热回流至锥形瓶中液体无明显增加为止。
A中碎瓷片的作用是?
锥形瓶中的液体主要是?,采用边反应边将其蒸出的方法的目的是??。
(2)制备精品
①反应结束后,冷却反应物至室温。将装置A中的反应混合物倒入分液漏斗中,用少量饱和食盐水荡洗反应瓶,一起并入分液漏斗。用饱和食盐水代替蒸馏水的优点是?。
②振摇分液漏斗,静置分层后分去水层。有机层先用25 mL 10% 碳酸钠水溶液洗涤除去?杂质 ,再用水洗涤两次。分尽水层后将酯层转入干燥的锥形瓶中,用?(填写选项)干燥0.5h。
a.五氧化二磷? b.碱石灰? c.无水硫酸镁? d.生石灰
③将干燥后的液体过滤到装置A中,加热蒸馏收集?℃的馏分,称重,产物重8.4g,则该实验的产率为?。(保留两位有效数字)
参考答案:(1)?蒸馏烧瓶(1分)? ___g_(1分)
?防止暴沸?(2分)
?水 ?(2分), 将水蒸出,推动酯化反应平衡正向移动 ,有利于酯的生成?(2分)
(2)①?降低乙酸异戊酯的溶解度,有利于分层?(2分)
②?醋酸?(2分)??c?(2分)
③? 140?℃?(2分)??70%?(保留两位有效数字)(2分)
本题解析:略
本题难度:一般
2、简答题 物质的浓度差异可导致物质的性质发生改变,不同浓度的物质在发生化学反应时其反应速率也会发生改变.
(1)浓硫酸具有:①强氧化性;②吸水性;③脱水性.以下过程主要表现浓硫酸的那些性质?请将答案填在横线上.
a.纸张、木条等遇浓硫酸会慢慢变黑;______(填写序号,下同).
b.浓硫酸可用于干燥H2、O2、SO2等气体;______.
c.常温下,铁或铝在浓硫酸中钝化;______.
(2)某学生进行了“浓度影响化学反应速率”的探究实验,原始数据记录如下:
| Zn的质量 | H2SO4的浓度 | 收集20mLH2所需的时间
①
10g(锌粉)
0.1mol/L
125s
②
10g(锌粉)
0.2mol/L
62s
|
①上述反应的方程式为:Zn+H2SO4=ZnSO4+H2↑,该反应既属于氧化还原反应,又属于______反应(填四大基本反应类型名称).
②比较两组数据可知:硫酸的浓度越大,化学反应速率______(填“越快”、“越慢”或“不变”).
参考答案:(1)a、纸张、木条等的组成元素主要是碳、氢、氧元素,遇浓硫酸会班氢元素原子和氧元素原子按照2:1的组成脱去剩余碳慢慢变黑表现了浓硫酸的脱水性;故答案为:③;
b、浓硫酸具有吸水性,能吸收气体中的水蒸气;故答案为:②;
c、常温下,铁或铝在浓硫酸中钝化,利用的是浓硫酸的强氧化性在金属铁、铝表面形成一层致密的氧化物薄膜,阻止反应进行;故答案为:①
(2)①Zn+H2SO4=ZnSO4+H2↑,反应是单质和化合物反应生成另一种单质和化合物的反应是置换反应,反应过程中元素化合价变化,是氧化还原反应;故答案为:置换反应;
②依据图表中数据,浓度大的硫酸溶液与同量锌反应时需要的时间短,说明所以速率大,故答案为:越快.
本题解析:
本题难度:简单
3、实验题 在化学课上,围绕浓硫酸的化学性质进行了如下实验探究:将适量的蔗糖放入烧杯中,加入几滴水,搅拌均匀。然后再加入适量浓硫酸,迅速搅拌,放出大量的热,同时观察到蔗糖逐渐变黑,体积膨胀,并产生刺激性气味的气体。
请回答:
(1)生成的黑色物质是_____________(填化学式)。
(2)刺激性气味的气体主要成分是______(填化学式),产生该气体的化学方程式为______________。
(3)根据上述实验现象,表明浓硫酸具有_______________(填序号)。
① 酸性 ② 吸水性 ③ 脱水性 ④ 强氧化性
参考答案:(1)C?
(2)SO2;C+2H2SO4(浓) CO2↑+2SO2↑+2H2O
CO2↑+2SO2↑+2H2O
(3)②③④
本题解析:
本题难度:一般
4、选择题 下列关于工业生产的叙述错误的是?
[? ]
A.用离子交换膜法电解饱和食盐水制烧碱
B.目前合成氨,没有采用更大压强是从设备和动力要求方面考虑的
C.采用电解熔融氯化铝的方法制取金属铝
D.生产硫酸时,接触室内热交换器的作用是预热进入的炉气和冷却反应生成的气体
参考答案:C
本题解析:
本题难度:简单
5、选择题 乙二酸可以被强氧化剂氧化为CO2,现有0.10mol/L乙二酸溶液20mL,恰好被4×10— 3 mo lVO2+ 所氧化,则此反应的还原产物VOn+中n的值为
A.5
B.4
C.3
D.2
参考答案:D
本题解析:
正确答案:D
由电子守恒得:0.10mol/L×20×10— 3 L×(4-3)×2=4×10— 3 mol×(5-(n+2)),解得n=2.
本题难度:一般