1、简答题 硫酸是一种实验室常用的化学试剂.请按要求填空:
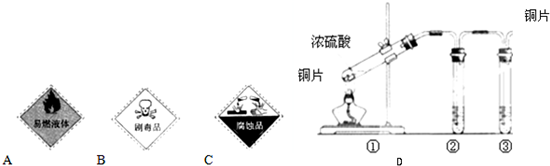
(1)浓硫酸试剂瓶上适合贴上的图标是______(填写字母标号).
(2)实验室有1.00mol?L-1的硫酸溶液,从中准确量出10.00mL,其物质的量浓度为______mol?L-1.现将准确量出的10.00mL的硫酸溶液配制成0.100mol?L-1的稀硫酸,所需要的玻璃仪器除烧杯、玻璃棒还需______和______.
(3)用图D所示的实验装置验证铜与浓硫酸反应生成的气体产物,则装置②、③试剂依次为下列的______和______
A.品红溶液B.BaCl2溶液 C.NaOH溶液D.AgNO3溶液
(4)装置①中发生反应的化学方程式为______,若装置①中加入铜6.4g和含有0.2molH2SO4的浓硫酸,则产生二氧化硫质量______
A.等于6.4克B.大于6.4克C.小于6.4克D.不能确定
(5)若将装置①中的铜片换成木炭,装置②试管内为品红溶液,装置③试管内为澄清石灰水,则装置①中发生反应的化学方程式为______.装置②中的现象是______.根据装置③观察到有白色沉淀生成的现象,______(填“能”或“不能”)判断该白色沉淀一定只有CaCO3.
参考答案:(1)浓硫酸具有腐蚀性,适合贴上的图标是图中的C,故答案为:C;
(2)溶液为稳定、均一的分散系,则实验室有1.00mol?L-1的硫酸溶液,从中准确量出10.00mL,其物质的量浓度应仍为1.00mol?L-1,将准确量出的10.00mL的硫酸溶液配制成0.100mol?L-1的稀硫酸,应将体积稀释为100mL,则配制溶液时用到的玻璃仪器有烧杯、量筒、玻璃棒、胶头滴管以及100mL容量瓶等仪器,
故答案为:1.00;胶头滴管;100mL容量瓶;
(3)铜和浓硫酸反应生成二氧化硫,二氧化硫具有漂白性,可先后品红检验,因二氧化硫有毒,不能排放到空气中,可用氢氧化钠吸收,故答案为:A;C;
(4)铜和浓硫酸在加热条件下发生氧化还原反应,反应的方程式为Cu+2H2SO4(浓)△.CuSO4+SO2↑+2H2O,随着反应的进行,硫酸浓度逐渐降低,稀硫酸和铜不反应,则生成的二氧化硫小于0.1mol,质量小于6.4g,
故答案为:Cu+2H2SO4(浓)△.CuSO4+SO2↑+2H2O;C;
(5)碳和浓硫酸在加热条件下发生氧化还原反应生成二氧化碳和二氧化硫,反应的方程式为C+2H2SO4(浓)△.CO2↑+2SO2↑+2H2O,生成的二氧化硫可使品红溶液由红色变为无色,因二氧化硫和二氧化碳都能与氢氧化钙溶液反应生成沉淀,则不能断该白色沉淀一定只有CaCO3.
故答案为:C+2H2SO4(浓)△.CO2↑+2SO2↑+2H2O;溶液由红色变为无色;不能.
本题解析:
本题难度:简单
2、填空题 实验证明铜在低温下不能和O2发生反应,也不能和稀硫酸共热发生反应,但工业上却是将废铜屑倒入热的稀硫酸中并不断通入空气来制取CuSO4溶液,铜屑在此状态下发生的一系列化学反应为:_____________________,__________________。利用铜和浓硫酸在加热条件下也能制备CuSO4溶液,其化学方程式为_________________。以上方法前者好还是后者好? _____。原因是________________________
参考答案:2Cu+O2 2CuO;CuO+H2SO4=CuSO4+H2O;Cu+2H2SO4(浓)
2CuO;CuO+H2SO4=CuSO4+H2O;Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O;前者好;这种方法节约原料(硫酸),②清洁,无污染,后者有SO2气体生成,节约能源,加热温度比第二种方法低
CuSO4+SO2↑+2H2O;前者好;这种方法节约原料(硫酸),②清洁,无污染,后者有SO2气体生成,节约能源,加热温度比第二种方法低
本题解析:
本题难度:一般
3、选择题 “类推”是常用的学习方法,但是有时会产生错误结论.下列类推结论中正确的是( )
A.钠在空气中可生成氧化钠、过氧化钠,则锂可生成氧化锂、过氧化锂
B.第2周期元素氢化物稳定性顺序是HF>H2O>NH3;则第三周期元素氢化物稳定性的顺序也是HCl>H2S>PH3
C.卤素单质的沸点从上到下依次升高,则碱金属单质的沸点从上到下也依次升高
D.浓硫酸敞口放在空气中质量增大,浓度变小,则浓硝酸敞口放在空气中也质量增大,浓度变小
参考答案:A、金属锂在空气中燃烧只能生成氧化锂,故A错误;
B、元素的非金属性越强,对应氢化物的稳定性越大,由于非金属性Cl>S>P,则稳定性HCl>H2S>PH3,故B正确;
C、卤素单质属于分子晶体,单质的相对分子质量越大,沸点越高,碱金属单质属于金属晶体,原子半径越大,沸点越低,故C错误;
D、浓硫酸具有吸水性,敞口放在空气中质量增大,浓度变小,浓硝酸易挥发,浓硝酸敞口放在空气中质量减小,浓度变小,故D错误.
故选B.
本题解析:
本题难度:一般
4、简答题 工业上常用铁质容器盛装冷浓硫酸.为研究铁质材料与热浓硫酸的反应,某学习小组进行了以下探究活动:
(1)将已去除表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移入硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是______.
(2)另称取铁钉6.0g放入15.0ml浓硫酸中,加热,充分应后得到溶液X并收集到气体Y.
①甲同学认为X中除Fe3+外还可能含有Fe2+.写出生成Fe2+所有可能的离子反应方程式:______.若要确认其中有Fe2+,应选用______(选填序号).
a.KSCN溶液和氯水b.铁粉和KSCN溶液c.浓氨水d.酸性KMnO4溶液
②乙同学取336ml(标准状况)气体Y通入足量溴水中,发生反应的化学方程式为:______.然后加入足量BaCl2溶液,经适当操作后得干燥固体2.33g.由于此推知气体Y中SO2的体积分数为______.
参考答案:(1)铁钉(碳素钢)放入冷浓硫酸中,浓硫酸有较强的氧化性能使铁钉钝化阻止反应进一步进行,故答案为:铁表面被钝化;
(2)①在加热条件下,浓硫酸与Fe反应生成Fe3+,当溶液浓度减小时,硫酸氧化性减弱,生成Fe2+,反应的离子方程式为Fe+2H+=Fe2++H2↑,如硫酸完全消耗,且铁过量时,还会发生
Fe+2Fe3+=3Fe2+,+2价亚铁离子能使酸化的高锰酸钾褪色,溶液中已经有+3价铁离子,选择a会造成干扰,选b只能检验溶液中含有+3价铁离子,选c会造成两种沉淀,受氢氧化铁颜色的影响无法辨别,只能选d,故答案为:Fe+2H+=Fe2++H2↑; Fe+2Fe3+=3Fe2+;d;
②SO2具有还原性,通入足量溴水中,发生SO2+Br2+2H2O=2HBr+H2SO4,
n(混合气体)=0.336L22.4L/mol=0.015mol,
SO2→BaSO4
1mol 233g
n 2.33g
n=0.01mol
则SO2的体积分数:0.010.015×100%=66.7%,
故答案为:SO2+Br2+2H2O=2HBr+H2SO4;66.7%.
本题解析:
本题难度:一般
5、选择题 下列物质中不能与乙酸反应的是
A.Cu(OH)2
B.Na
C.CH3CHO
D.Na2CO3
参考答案:C
本题解析:略
本题难度:简单