1、选择题 有X、Y、Z三种元素,X和Y可形成XY和XY2两种化合物;Z与X、Y分别形成XZ4和Z2Y两种化合物,这两种化合物的电子总数都为10,则X、Y、Z三种元素分别是
A.C、N、O
B.C、O、H
C.C、H、O
D.H、N、O
参考答案:B
本题解析:由题意得X、Y分别为C、O,组成的化合物为CO2、CO;Z为H,与X、Y组成的化合物分别为CH4、H2O,电子数均为10.
本题难度:简单
2、推断题 有关元素X、Y、Z、D、E的信息如下:

请回答下列问题(用化学用语表示):
(1)X的一种氢化物可用于实验室制取X的单质,其反应的化学方程式为___________________________。
(2)比较Y与Z的氢化物的稳定性________(用化学式表示)。
(3)E元素与Y元素可形成EY2和EY3两种化合物,则下列说法中正确的是________(填序号) ①通常实验室配制EY3溶液时,可直接用水溶解EY3固体 ②EY2不能通过单质直接化合产生 ③铜片、碳棒和EY3溶液组成原电池,电子由铜片沿导线流向碳棒 ④Y、Z、D的离子半径大小依次减小
(4)Y的最高价氧化物为无色液体,当0.25 mol该物质与一定量的水混合得到一种稀溶液时,放出Q kJ的热量.写出该反应的热化学方程式______________________________。
(5)写出E在潮湿的空气中发生腐蚀时正极上的电极反应式_____________________。
参考答案:(1)2H2O2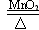 2H2O+O2↑
2H2O+O2↑
(2)HCl>H2S
(3)②③
(4)Cl2O7(l)+H2O(l)===2HClO4(aq) ΔH=-4Q kJ/mol
(5)O2+2H2O+4e-===4OH-
本题解析:
本题难度:一般
3、选择题 下列叙述中正确的是
[? ]
A.同周期元素中,ⅦA族元素的原子半径最大
B.ⅥA族元素的原子,其半径越大.越容易得到电子
C.当各轨道处于全满、半满、全空时原子较稳定
D.同一周期中,碱金属元素的第一电离能最大
参考答案:C
本题解析:
本题难度:简单
4、选择题 下列说法中正确的是
[? ]
A.非金属元素呈现的最高化合价不超过该元素原子的最外层电子数
B.非金属元素呈现的最低化合价,其绝对值等于该元素原子的最外层电子数
C.最外层有2个电子的原子都是金属原子
D.最外层有5个电子的原子都是非金属原子
参考答案:A
本题解析:
本题难度:简单
5、填空题 元素在周期表中的位置,反映了元素的原子结构和元素的性质.右图是元素周期表的一部分.
(1)阴影部分元素N的最高价氧化物为______.根据元素周期律,请你预测:H3AsO4、H3PO4的酸性强弱:H3AsO4______H3PO4.(用“>”、“<”或“=”表示)
(2)元素S的最高正价和最低负价分别为______、______,
(3)在一定条件下,S与H2反应有一定限度(可理解为反应进行的程度),请判断在相同条件下Se与H2反应的限度______(选填“更大”、“更小”或“相同”).
(4)羰基硫(COS)分子结构与二氧化碳分子结构相似,所有原子的最外层都满足8电子结构.请写出羰基硫分子的电子式______
(5)单质砷和热的浓H2SO4反应,生成As2O3,反应的化学方程式为______.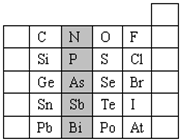
参考答案:(1)阴影部分元素的最外层电子数为5,最外层电子数=族序数=元素的最高正价,所以是第二周期第ⅤA族的N元素,N的最高价氧化物为N2O5,同周期元素,从左到右最高价氧化物对应水化物的酸性逐渐增强,同主族从上到下最高价氧化物对应水化物的酸性逐渐减弱,所以酸性H3PO4>H3AsO4,故答案为:N2O5;<;
(2)硫元素的最高正价=最外层电子数=+6,最低负价=最外层电子数-8=-2,故答案为::+6;-2;
(3)S和Se是同主族元素,同主族元素性质具有相似性和递变性,按照O、S、Se的顺序单质和氢气反应的限度逐渐减小,故答案为:更小;
(4)羰基硫(COS)分子结构与二氧化碳分子结构相似,二氧化碳中碳原子和氧原子间是双键,为直线型的结构,所以羰基硫分子的电子式为:
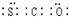
,
故答案为:
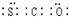
;
(5)浓硫酸有强氧化性,还原产物是二氧化硫,所以单质砷和热的浓H2SO4反应的方程式为:2As+3H2SO4(浓)?△?.?As2O3+3SO2↑+3H2O,
故答案为:2As+3H2SO4(浓)?△?.?As2O3+3SO2↑+3H2O.
本题解析:
本题难度:一般