|
高中化学知识点归纳《电解池原理》高频试题特训(2019年最新版)(十)
2019-07-03 23:07:11
【 大 中 小】
|
1、选择题 如图所示甲、乙两个装置,所盛溶液体积和浓度均相同且足量,当两装置电路中通过的电子都是1 mol时,下列说法不正确的是
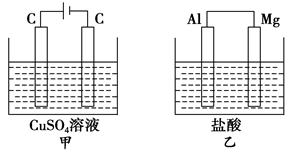
A.溶液的质量变化:甲减小乙增大
B.溶液pH变化:甲减小乙增大
C.相同条件下产生气体的体积:V甲=V乙
D.电极反应式:甲中阴极为Cu2++2e-===Cu,乙中负极为Mg-2e-===Mg2+
|
参考答案:D
本题解析:A.甲中总反应为:2CuSO4+2H2O=2Cu+2H2SO4+O2↑,乙中总反应为:Mg+2HCl=MgCl2+H2↑,故甲溶液质量减小,乙溶液质量增大,故A正确; B.甲中生成H2SO4,pH减小,乙中消耗HCl,pH增大,故B正确;C.甲中阴极为Cu2+放电,电极反应为Cu2++2e-=Cu,乙中负极为镁放电,电极反应为:Mg-2e-=Mg2+,故C正确;D.当两装置电路中通过的电子都是0.1mol时,甲中产生0.025molO2,乙中产生0.05molH2,故相同条件下,甲乙中产生气体的体积比为1:2,故D错误
考点:本题考查原电池和电解池的原理
本题难度:一般
2、选择题 用铅蓄电池电解AgNO3、Na2SO3的溶液,a、b、c、d电极材料均为石墨。已知铅蓄电池的总反应为:
Pb(s)+PbO2(s)+ 2H2SO4( aq) 2PbSO4(s) +2H2O(1),通电时a电极质量增加,下列说法正确的是 2PbSO4(s) +2H2O(1),通电时a电极质量增加,下列说法正确的是

[? ]
A.电路中通过1 mol电子时,Y电极质量增加48 g
B.放电时铅蓄电池负极的电极反应式为:PbO2(s) +4H+ (aq)+SO42- (aq)+4e-==PbSO4 (s)+ 2H2O(1)
C.c、d电极产生气体的物质的量之比为1:2
D.X极为负极
参考答案:A
本题解析:
本题难度:一般
3、选择题 关于下列说法中正确的是( )
A.用惰性电极电解熔融氯化钠的离子方程式为:2Cl-+2H2O Cl2↑+H2↑+2OH- Cl2↑+H2↑+2OH-
B.用惰性电极分别电解CuCl2溶液和MgCl2溶液分别得到单质Cu和Mg
C.下图为电解足量氯化钠溶液的装置,一段时间后两极收集到气体的体积之比为1∶1

D.电解精炼铜时,相同时间内阴极析出铜的质量比阳极溶解铜的质量大
参考答案:D
本题解析:熔融的氯化钠无水,A错误;MgCl2溶液中的H+得电子,B错误;阴极2H++2e- H2↑、阳极2Cl--2e- H2↑、阳极2Cl--2e- Cl2↑,依据电子守恒生成的H2、Cl2的物质的量之比为1∶1,但氯气溶于水,能与NaOH溶液反应,所以收集到的氯气一定比氢气少,C错误;阴极只发生Cu2++2e- Cl2↑,依据电子守恒生成的H2、Cl2的物质的量之比为1∶1,但氯气溶于水,能与NaOH溶液反应,所以收集到的氯气一定比氢气少,C错误;阴极只发生Cu2++2e- Cu,而阳极除发生Cu-2e- Cu,而阳极除发生Cu-2e- Cu2+,还可能发生Zn-2e- Cu2+,还可能发生Zn-2e- Zn2+、Fe-2e- Zn2+、Fe-2e- Fe2+等,所以D选项正确 Fe2+等,所以D选项正确
本题难度:一般
4、选择题 用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,向所得溶液中加入0.1molCu(OH) 2后恰好恢复到电解前的浓度和pH。则电解过程中转移的电子数为
A.0.1mol
B.0.2mol
C.0.3mol
D.0.4mol
参考答案:D
本题解析:Cu(OH)2从组成上可看成CuO?H2O,加入0.1 mol Cu(OH)2后恰好恢复到电解前的浓度和pH,即电解生成了0.1 mol H2SO4,并消耗0.1 mol H2O,由电解的总反应式为:
2H2O+2CuSO4 2Cu+O2↑+2H2SO4 ?转移电子 2Cu+O2↑+2H2SO4 ?转移电子
2mol ?4mol
0.1mol ?0.2mol
2H2O 2H2↑+O2↑?转移电子 2H2↑+O2↑?转移电子
2mol?4mol
0.1mol ?0.2mol
所以电解过程中共转移电子为0.4 mol.
故选D。
点评:本题考查电解池的工作原理,电解池中有关电子转移数的计算技巧与能力,先根据原子守恒计算析出铜单质的物质的量,再根据铜与转移电子之间的关系计算转移电子的物质的量。难度稍难。
本题难度:一般
5、选择题 LiFePO4新型锂离子动力电池是奥运会绿色能源的新宠。已知该电池放电时的电极反应式为:
正极 FePO4+Li++e-==LiFePO4 ,负极 Li-e-== Li+下列说法中正确的是
[? ]
A.充电时电池反应为FePO4+Li = LiFePO4
B.充电时动力电池上标注“+”的电极应与外接电源的正极相连
C.放电时电池内部Li+向负极移动
D.放电时,在正极上是Li+得电子被还原
参考答案:B
本题解析:
本题难度:一般
|