1、填空题 (10分)(1) 0.5 mol H2SO4的质量是_________g,含__________个分子,含_______mol氧原子,能和_________mol NaOH完全反应,该硫酸所含氢元素的质量与________mol H3PO4或_______ g HCl中所含氢元素的质量相同。
(2)含有相同氧原子数的CO和CO2,其质量比为?;同温同压下的体积比为?。
参考答案:(1) 49 ;0.5 NA(3.01×1023) ;2 ;1 ;1/3 ;36.5 (各1分)
(2) 14:11 ;2:1 (各2分)
本题解析:略
本题难度:简单
2、填空题 (1)完成下列基本计算:
①3.6 g H2O的物质的量为? ?mol;
②分子数为3.01×1023的H2的物质的量为? ?mol;
③标准状况下,8.96 L N2的物质的量为? ?mol;
④75 mL 2.0 mol·L-1 CaCl2溶液中含CaCl2? ?mol。
(2)选出下列各小题物质分离或提纯所依据的物理性质和分离方法。
?
| 性质差异
| 分离方法
|
①除去氯化钠溶液中的泥沙
| ?
| ?
|
②用四氯化碳提取溴水中的溴单质
| ?
| ?
|
③分离乙酸(沸点1180C)与乙酸乙酯(沸点77.10C)
| ?
| ?
|
④分离汽油和水
| ?
| ?
|
⑤从含有少量NaCl的KNO3溶液中提取KNO3
| ?
| ?
|
性质差异:A、溶解度随温度变化差异 ? B、在不同溶剂中的溶解度差异
C、沸点差异? D、互不相溶? E、在水中的溶解度差异
分离方法:a、蒸馏? b、过滤?c、分液? d、萃取? e、结晶
(3)工业电解食盐水制取氯气的化学方程式:?。
参考答案:(1)①0.2; ②0.5; ③0.4; ④0.15。
?(2)
?
性质差异
分离方法
①除去氯化钠溶液中的泥沙
E
b
②用四氯化碳提取溴水中的溴单质
B
d(或dc)
③分离乙酸(沸点1180C)与乙酸乙酯(沸点77.10C)
C
a
④分离汽油和水
D
c
⑤从含有少量NaCl的KNO3溶液中提取KNO3
A
e
 (3)2NaCl + 2H2O? 2NaOH+H2↑ + Cl2↑
(3)2NaCl + 2H2O? 2NaOH+H2↑ + Cl2↑
本题解析:略
本题难度:简单
3、计算题 在25℃,101kPa条件下,将15 L O2通入10 L CO和H2的混合气中,使其完全燃烧,干燥后,恢复至原来的温度和压强。
(1) 若剩余气体的体积是15L,则原CO和H2的混合气中V(CO)= L, V(H2)= L。
(2)若剩余气体的体积为aL,则a的取值范围是: 计算过程:
参考答案:(1)5 5 (2)10 < a < 20
本题解析:(1)设V(CO)为xL,则V(H2)为(10-x)L
由2CO + O2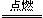 2CO2 ?V
2CO2 ?V
2 1 2 1
x x/2
2H2 + O2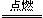 2H2O ?V
2H2O ?V
2 1 3
10-x 3/2(10-x)
则x/2 + 3/2(10-x)=15+10-15,解得x=5,即V(CO)为5L,,V(H2)为(10-x)L=5L。
(2)若剩余气体的体积为aL,则x/2 + 3/2(10-x)=15+10-a,得a=10+x,因为0<x<10,则10<a<20。
考点:本题考查差量法及有关混合物反应的计算。
本题难度:一般
4、选择题 在相同条件下,两种物质的量相同的气体必然(? )
A.体积均为22.4L
B.具有相同的体积
C.是双原子分子
D.具有相同的原子数目
参考答案:B
本题解析:略
本题难度:简单
5、填空题 (8分)用20g烧碱配制成500mL溶液,其物质的量浓度为 mol/L;从中取出1mL,若将这1mL溶液用水稀释到100mL,所得溶液中溶质的物质的量浓度为 mol/L;9.03×1023个氨分子含 摩尔氢原子; 个电子。
参考答案:1mol/L、0.01mol/L、 4.5mol 、9.03×1024
本题解析:首先依据公式计算: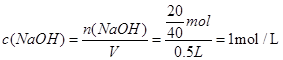 ;从溶液中取出1mL,若将这1mL溶液用水稀释到100mL,所得溶液中溶质的物质的量浓度为:
;从溶液中取出1mL,若将这1mL溶液用水稀释到100mL,所得溶液中溶质的物质的量浓度为: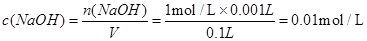 ;
;
首先换算氨分子为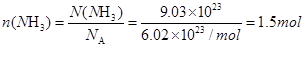 ,所以这些NH3含1.5×3mol=4.5mol氢原子;1.5×10×6.02×1023=9.03×1024个电子。
,所以这些NH3含1.5×3mol=4.5mol氢原子;1.5×10×6.02×1023=9.03×1024个电子。
考点:考查物质的量相关计算
点评:熟练掌握有关计算公式很重要
本题难度:一般