1、选择题 有PH分别为8、9、10的三种相同物质的量浓度的盐溶液NaX、NaY、NaZ,以下说法中不正确的是
[? ]
A.在三种酸HX、HY、HZ中以HX酸性相对最强
B.HX、HY、HZ三者均为弱酸
C.在X-、Y-、Z-三者中,以Z-最易发生水解
D.中和1molHY酸,需要的NaOH稍小于1mol
参考答案:D
本题解析:
本题难度:一般
2、选择题 下列判断正确的是( )
A.同温下,HF比HClO易电离,则NaF溶液的pH比NaClO溶液的pH大
B.常温下,BaSO4在饱和Na2SO4溶液中的Ksp比在纯水中的Ksp小
C.常温下,0.4mol?L-1 HA溶液和0.2mol?L-1 NaOH溶液等体积混合后的pH等于3,则混合溶液中粒子浓度大小关系:c(A-)>c(Na+)>c(HA)>c(H+)>c(OH-)
D.用铂电极电解食盐水,一段时间后两极产生气体体积比为3:2(同条件下),为将电解液恢复原状,则只需向电解液中通入一定量的HCl气体
参考答案:A.同温下,酸的电离程度越小其酸性越弱,则酸根离子水解程度越大,水解程度越大,则相同浓度的钠盐溶液的PH越大,所以等浓度等体积NaF溶液的pH比NaClO溶液的pH小,故A错误;
B.常温下,BaSO4在饱和Na2SO4溶液中的Ksp和在纯水中的Ksp是相等的,故B错误;
C.二者混合后,溶液中的溶质是等物质的量浓度的HA和NaA,溶液呈酸性,说明酸的电离程度大于酸根离子水解程度,根据电荷守恒得c(A-)>c(Na+),因为酸的电离程度较小,所以c(Na+)>c(HA),溶液中氢氧根离子和氢离子浓度较小,所以离子浓度大小顺序是c(A-)>c(Na+)>c(HA)>c(H+)>c(OH-),故C正确;
D.用铂电解电解饱和食盐水时,如果只生成氯气和氢气,二者的体积相等,实际上不相等,说明阳极上有氧气生成,所以实质上电解的是氯化氢和水,要使溶液恢复原状,则应该加入盐酸溶液,故D错误;
故选C.
本题解析:
本题难度:简单
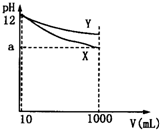
3、选择题 pH=12的X、Y两种碱溶液各10mL,分别稀释至1000mL,其pH与溶液体积(V)的关系如图所示,下列说法正确的是( )
A.X、Y两种碱的物质的量浓度一定相等
B.若10<a<12,则X、Y都是弱碱
C.完全中和X、Y两溶液时,消耗同浓度盐酸的体积VX>VY
D.稀释后,X溶液的碱性比Y溶液的碱性强