|
|
|
高中化学知识点归纳《键参数——键能、键长与键角》答题技巧(2019年最新版)(七)
2019-07-03 23:15:31
【 大 中 小】
|
1、填空题 铜、碳、氮、硫、氯等是组成物质的重要元素。
(1)S、Cl组成的一种化合物的分子结构与H2O2相似,则此化合物的结构式为?。
N、O、S三种元素的电负性由大到小的顺序为?。
(2)铜离子是人体内多种酶的辅因子,人工模拟酶是当前研究的热点。某化合物Y 与Cu(Ⅰ)(Ⅰ表示化合价为+1)结合形成图所示的离子:
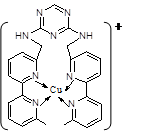
①写出Cu(Ⅰ)的电子排布式?;
②该离子中含有化学键的类型有?(选填序号);
A.极性键
B.离子键
C.非极性键
D.配位键
| ③该离子中C原子的杂化方式有?。
(3)向氯化铜溶液中通入足量的二氧化硫,生成白色沉淀M,M的结构如图所示。写出该反应的离子方程式?。

2、简答题 “HCl溶于水后形成H+和Cl-,但HCl不是离子化合物”你怎样理解这一句话。
_____________________________________________________。
3、选择题 黑火药是中国四大发明之一,其爆炸的化学反应方程式是:
2KNO3 + 3C + S→ + N2↑ + 3CO2↑? + N2↑ + 3CO2↑?
(1)方程式中第二周期元素中非金属性由强到弱的顺序依次为?。
(2)上述元素中,元素原子最外层有2个未成对电子的是?。
(3)在生成物中:A物质的晶体类型为?;构成晶体A的微粒半径大小关系为?(用微粒符号表示);含极性共价键的非极性分子为?。
(4)已知CN—与N2结构相似,写出HCN分子的结构式?。
4、填空题 (15分)氮的化合物在无机化工领域有着重要的地位。请回答下列问题:
(1)基态氮原子的价电子排布图为______。氮的最高价氧化物为无色晶体,它由两种离子构成:已知其阴离子构型为平面正三角形,则其阳离子的构型为?形,阳离子中氮的杂化轨道类型为?。
(2)某氮铝化合物X具有耐高温、抗冲击、导热性好等优良性质,广泛用于陶瓷工业等领域。工业上用氮气与氧化铝和碳在一定条件下反应生成X和CO,X的晶体结构如图所示,工业制备X的化学方程式为____。
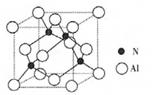
(3)X晶体中包含的化学键类型为______。(填字母标号)
A.离子键
B.共价键
C.配位键
D.金属键
|
(4)已知氮化硼与X晶体类型相同,且氮化硼的熔点比X高,可能的原因是______
(5)若X的密度为pg/cm3,则晶体中最近的两个N原子的距离为______cm(阿伏加德罗常数用NA表示,不必化简)。
5、填空题 ①Cu、②NaOH、③I2、④MgCl2、⑤Na2O2、⑥Ar,回答下列问题。
(1)不存在化学键的是_________;
(2)存在金属键的是_________;
(3)只存在非极性键的是_________;
(4)只存在离子键的是_______;
(5)既存在离子键又存在极性键的是________;
(6)既存在离子键又存在非极性键的是________。
