| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点归纳《键参数——键能、键长与键角》答题技巧(2019年最新版)(八)
(3)向氯化铜溶液中通入足量的二氧化硫,生成白色沉淀M,M的结构如图所示。写出该反应的离子方程式?。  参考答案: 本题解析: 本题难度:一般 2、简答题 “HCl溶于水后形成H+和Cl-,但HCl不是离子化合物”你怎样理解这一句话。 参考答案:离子化合物是由阳离子和阴离子形成的化合物。氢元素和氯元素都是非金属元素,这样的原子相互结合时不是发生电子得失,而是形成共用电子对,即HCl是由H原子和Cl 原子通过共价键形成的化合物,属于共价化合物,不是离子化合物。HCl在水溶液里变为H+和Cl-,这是HCl分子受水分子的作用发生电离的结果,不能以这种发生变化以后的结果为条件判定HCl是离子化合物。 本题解析: 本题难度:一般 3、选择题 黑火药是中国四大发明之一,其爆炸的化学反应方程式是: 参考答案:(1)O、 N、 C(2分);(2)C、S、O(2分);(3)离子晶体(1分),S2->K+(1分); CO2(1分)。(4)H-C≡N(1分) 本题解析:根据质量守恒定律,不难确定物质A的化学式:K2S。(1)同周期元素的非金属性,从左往右逐渐增强,方程式中第二周期元素中非金属性由强到弱的顺序依次为O、 N、 C。(2)上述元素中,元素原子最外层有2个未成对电子的是C(2s22p2)、S(3s23p4)、O(2s22p4)。(3)K2S物质的晶体类型为离子晶体;S2-和K+的核外具有相同的电子层结构,核电荷数越大,离子半径越小,微粒半径大小关系为S2->K+;含极性共价键的非极性分子为 CO2。(4)已知CN—与N2结构相似,写出HCN分子的结构式H-C≡N。 本题难度:一般 4、填空题 (15分)氮的化合物在无机化工领域有着重要的地位。请回答下列问题: |
参考答案:(1)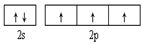 ?直线? sp (2)? Al2O3+N2+3C
?直线? sp (2)? Al2O3+N2+3C 2AlN+3CO?(3)B、C
2AlN+3CO?(3)B、C
(4)氮化硼与氮化铝均为原子晶体,且硼原子半径小于铝原子半径,B—N键键能大于Al—N键键能?(5)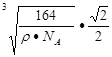
本题解析:(1)7号元素N的核外电子排布式是1s22s22p3,所以基态氮原子的价电子排布图为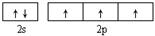 ;氮的最高价氧化物N2O5为无色晶体,它由两种离子构成:NO2+(硝酰阳离子)和NO3-(硝酸根离子),其中阳离子呈直线型,阳离子中氮的杂化轨道类型为sp杂化,阴离子构型为平面正三角形; (2) 工业制备X的化学方程式为Al2O3+N2+3C
;氮的最高价氧化物N2O5为无色晶体,它由两种离子构成:NO2+(硝酰阳离子)和NO3-(硝酸根离子),其中阳离子呈直线型,阳离子中氮的杂化轨道类型为sp杂化,阴离子构型为平面正三角形; (2) 工业制备X的化学方程式为Al2O3+N2+3C 2AlN+3CO;(3)在AlN晶体中包含的化学键类型为共价键、配位键。因此选项为B、C。(4)已知氮化硼与AlN晶体类型相同,且氮化硼的熔点比AlN高,可能的原因是氮化硼与氮化铝均为原子晶体,且硼原子半径小于铝原子半径,使得B—N键的键能大于Al—N键的键能。(5)在每个晶胞中含有的Al原子的个数为:8×1/8+6×1/2=4;N:1×4=4.因此含有4个AlN。设晶胞的变成为L,则
2AlN+3CO;(3)在AlN晶体中包含的化学键类型为共价键、配位键。因此选项为B、C。(4)已知氮化硼与AlN晶体类型相同,且氮化硼的熔点比AlN高,可能的原因是氮化硼与氮化铝均为原子晶体,且硼原子半径小于铝原子半径,使得B—N键的键能大于Al—N键的键能。(5)在每个晶胞中含有的Al原子的个数为:8×1/8+6×1/2=4;N:1×4=4.因此含有4个AlN。设晶胞的变成为L,则 ;
; 则晶体中最近的两个N原子的距离为
则晶体中最近的两个N原子的距离为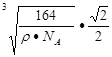 cm。在晶胞中每个Al原子结合4个N原子,每个N原子结合4个Al原子,2个Al原子之间的距离与2个N原子的距离相等,都等于面对角线的一半,所以2个N原子之间的距离等于
cm。在晶胞中每个Al原子结合4个N原子,每个N原子结合4个Al原子,2个Al原子之间的距离与2个N原子的距离相等,都等于面对角线的一半,所以2个N原子之间的距离等于 。
。
本题难度:一般
5、填空题 ①Cu、②NaOH、③I2、④MgCl2、⑤Na2O2、⑥Ar,回答下列问题。
(1)不存在化学键的是_________;
(2)存在金属键的是_________;
(3)只存在非极性键的是_________;
(4)只存在离子键的是_______;
(5)既存在离子键又存在极性键的是________;
(6)既存在离子键又存在非极性键的是________。
参考答案:(1)⑥
(2)①
(3)③
(4)④
(5)②
(6)⑤
本题解析 :
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学试题《大气污染与治理》.. | |