1、推断题 A、B、C、D、E五种短周期元素,已知:
①原子半径递增顺序为:A、D、C、B、E
②短周期(除稀有气体元素外)所有元素中A的原子半径与E的原子半径之比为最小
③B、C、D三种元素电子层相同,三者原子序数之和为21,且D原子次外层电子数为最外层电子数13;
请回答下列问题:
(1)写出E单质在D单质中燃烧产物的电子式:____________________
(2)C2A4·H2O与NH3·H2O相似,水溶液也呈弱碱性,用化学用语表示其水溶液呈弱碱性的原因:__________________;
(3)B、D、E三元素可组成常见化合物X,A、B、D、E可组成常见化合物Y,X、Y均是生活中常见的化学试剂,它们在一定条件下可互相转化。当a?mol?Y转化成a?mol?X时:(溶液中进行)
①若加入a?mol纯净物Z就可实现转化,则加入Z为:________(填一种Z物质名称)
②若加入0.5a?mol纯净物Z就可实现转化,则加入Z为:________(填一种Z物质化学式)
(4)C2A4可用作高能燃料电池的燃料,惰性材料作电极,KOH作电解质溶液构成原电池,写出负极的电极方程式:______________________;用该电池电解含0.25?mol?CuSO4和0.5?mol?NaCl混合溶液,当电池消耗10.4?g?C2A4时,则两电极生成的气体共________mol。
参考答案:(1)
(2)N2H4·H2O N2H5++OH-
N2H5++OH-
(3)①氢氧化钠(或其他合理答案);②Na2O(或其他合理答案)
(4)N2H4-4e-+4OH-==N2+4H2O;0.85
本题解析:
本题难度:一般
2、选择题 有A、B、C、D、E和F六瓶无色溶液,他们都是中学化学中常见的无机试剂。E的溶质是一种无色油状液体,B、C、D和F是盐溶液,且他们的阴离子均不同。现进行如下实验:
①A有刺激性气味,用沾有浓盐酸的玻璃棒接近A时产生白色烟雾;
②将A分别加入其他五种溶液中,只有D、F中有沉淀产生;继续加入过量A时,D中沉淀无变化,F中沉淀完全溶解;
③将B分别加入C、D、E、F中,C、D、F中产生沉淀,E中有无色、无味气体逸出;
④将C分别加入D、E、F中,均有沉淀生成,再加入稀HNO3沉淀均不溶。
根据上述实验信息,下列说法错误的是( )
A.B可能为NaHCO3溶液
B.F为AgNO3溶液
C.D不可能是镁或铝的盐酸盐
D.A为氨水,E为硫酸
参考答案:A
本题解析:E的溶质是一种无色油状液体,则E为H2SO4。①A为浓氨水;②加入过量A时,F中沉淀完全溶解,则沉淀为AgOH,F为AgNO3;③B+E(H2SO4)―→无色无味气体,气体为CO2,故B中含CO32—或HCO3—;④C+F(AgNO3)生成不溶于HNO3的沉淀,则沉淀必为AgX,故C中含X-;B+C―→沉淀,则沉淀只能是CaCO3或BaCO3,故C中含有Ba2+或Ca2+,则B中一定不含HCO3—;C+D反应产生不溶于HNO3的沉淀,所以D中含SO42—,沉淀为BaSO4,所以C中只含Ba2+,而不含Ca2+;加入过量A(NH3·H2O)时,D中沉淀无变化,该沉淀为氢氧化物沉淀,根据题意,应是Mg(OH)2或Al(OH)3沉淀,故D中含Mg2+或Al3+;B和D反应生成沉淀,由于没有气体生成,排除Al3+和CO32—的可能,故D中一定含Mg2+,因此A(浓氨水);B(含CO32—);C(BaCl2);D(MgSO4);E(H2SO4);F(AgNO3)。
本题难度:一般
3、推断题 A、B、C、 D、E都是原子序数依次增大的五种短周期元素,已知:
①A和C属同族元素,且A元素的原子半径是短周期元素原子中半径最小的;
②A和B能形成组成为A2B和A2B2的两种化合物;
③D元素原子所形成的离子在同周期元素原子形成的离子中半径是最小的;且D元素原子的最外层电子数是E元素原子最外层电子数的一半。
请回答:
(1)A元素是________;C元素是_________。D元素是_________。E元素是_________。(填元素符号)
(2)化合物A2B2的所含化学键______________电子式是____________;
(3)B和E形成两种常见化合物是_________和_________。
参考答案:(1)H;Na;Al;S
(2)极性键和非极性键;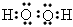
(3)SO2;SO3
本题解析:
本题难度:一般
4、简答题 如表是元素周期表的一部分,表中的每个字母表示一种短周期元素,回答下列问题:
| ? H | ? | ? | ? | ? | ? | ? | He
|
| ? | ? | ? | ? | ? | A | B | ?
|
| C | ? | D | ? | E | F | G | ?
|
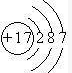
(1)画出G的原子结构示意图______
(2)A、B、E、F、G五种元素所形成的气态氢化物最稳定的是______(填化学式)
(3)C在元素周期表中的位置是第三周期______族.
(4)F、G元素的最高价氧化物对应水化物的酸性较强的是______(填酸的化学式)
(5)写出C、B形成化合物的电子式______.
参考答案:(1)G为Cl,质子数为17,电子层数为3,最外层电子数为7,原子结构示意图为
,故答案为:

;
(2)A、B、E、F、G五种元素中F的非金属性最强,则形成的气态氢化物HF最稳定,故答案为:HF;
(3)C为Na,原子结构中有3个电子层,最外层电子数为1,则在元素周期表中的第三周期第ⅠA族,故答案为:ⅠA;
(4)F、G元素的非金属性为Cl>S,则Cl的最高价氧化物对应水化物的酸性强,该酸为HClO4,故答案为:HClO4;
(5)C为Na,B为F,形成离子化合物,其电子式为
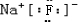
,故答案为:
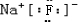
.
本题解析:
本题难度:一般
5、选择题 下列有关说法和结论都正确的是
A.已知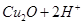 =
=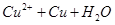 ,氢气还原氧化铜后所得红色固体能完全溶于稀硝酸,说明红色固体是铜
,氢气还原氧化铜后所得红色固体能完全溶于稀硝酸,说明红色固体是铜
B.用蒸馏水、酚酞、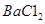 溶液和已知浓度盐酸标准溶液作试剂,可测定NaOH固体(杂质仅为
溶液和已知浓度盐酸标准溶液作试剂,可测定NaOH固体(杂质仅为 )的纯度
)的纯度
C.将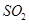 气体通入溴水中,溴水颜色逐渐褪去,说明
气体通入溴水中,溴水颜色逐渐褪去,说明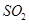 具有漂白性
具有漂白性
D.已知 的溶解度小于
的溶解度小于
参考答案:B
本题解析:A、Cu2O能与HNO3反应,溶于硝酸,所以氢气还原氧化铜后所得红色固体能完全溶于稀硝酸,红色固体可能是铜,也可能含Cu2O,错误;B、加入BaCl2溶液可除去杂质Na2CO3,然后用盐酸标准溶液滴定,可测定NaOH固体的纯度,正确;C、将SO2气体通入溴水中,溴水颜色逐渐褪去,Br2氧化SO2,体现了SO2的还原性,错误;D、Ag2CrO4与AgCl的化学式组成不同,所以不能直接根据Ksp的大小判断溶解度的大小,错误。sp与溶解度的关系。
本题难度:一般