1、实验题 (14分)化学兴趣小组对某品牌牙膏中摩擦剂成分及其含量进行以下探究:
查得资料:该牙膏摩擦剂由碳酸钙、氢氧化铝组成;牙膏中其他成分遇到盐酸时无气体产生。
Ⅰ.摩擦剂中氢氧化铝的定性检验。
取适量牙膏样品,加水充分搅拌、过滤。
(1)往滤渣中加入过量NaOH溶液,过滤。氢氧化铝与NaOH溶液反应的离子方程式是______________________________。
(2)往(1)所得滤液中先通入过量二氧化碳,再加入过量稀盐酸。观察到的现象是__________________________________________________________。
Ⅱ.牙膏样品中碳酸钙的定量测定。
利用如图所示装置(图中夹持仪器略去)进行实验,充分反应后,测定C中生成的BaCO3沉淀质量,以确定碳酸钙的质量分数。
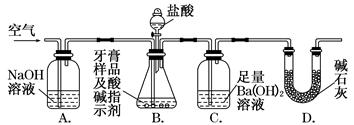
依据实验过程回答下列问题:
(3)实验过程中需持续缓缓通入空气。其作用除了可搅拌B、C中的反应物外,还有__________________________________________
(4)C中反应生成BaCO3的化学方程式是_____________________________________
(5)下列各项措施中,不能提高测定准确度的是________(填标号)。
a.在加入盐酸之前,应排净装置内的CO2气体
b.滴加盐酸不宜过快
c.在A~B之间增添盛有浓硫酸的洗气装置
d.在B~C之间增添盛有饱和碳酸氢钠溶液的洗气装置
(6)实验中准确称取8.00 g样品三份,进行三次测定,测得BaCO3平均质量为3.94 g。则样品中碳酸钙的质量分数为________。
(7)有人认为不必测定C中生成的BaCO3质量,只要测定装置C在吸收CO2前后的质量差,就可以确定碳酸钙的质量分数。实验证明按此方法测定的结果明显偏高,原因是______________________________。
参考答案:(1)Al(OH)3+OH-===AlO2-+2H2O或Al(OH)3+OH-===[Al(OH)4]-
(2)通入CO2气体有白色沉淀生成;加入盐酸有气体产生、沉淀溶解
(3)把生成的CO2全部排入C中,使之完全被Ba(OH)2溶液吸收
(4)Ba(OH)2+CO2===BaCO3↓+H2O?(5)c、d? (6)25%
(7)B中的水蒸气、HCl气体等进入装置C中(或其他合理答案)
本题解析:(1)氢氧化铝与NaOH溶液反应的离子方程式是Al(OH)3+OH-===AlO2-+2H2O
(2)向(1)中滤液中通过量的CO2气体有Al(OH)3白色沉淀生成,加入过量盐酸沉淀又溶解。
(3)通入空气还可以把生成的CO2全部排入C中,使之完全被Ba(OH)2溶液吸收。
(4)C中的反应方程式为Ba(OH)2+CO2===BaCO3↓+H2O
(5)在加入盐酸之前,应排净装置内的CO2气体可以提高测定的准确度,a不选;B装置中有酸碱指示剂,说明反应中盐酸的加入量是有限的,为保证准确,滴加过程要慢,b不选;B中装有溶液,因此气体通入前没有必要干燥,c选;在B—C之间连接盛有饱和NaHCO3溶液的洗气瓶会造成Ba(OH)2溶液还可能吸收由挥发出的氯化氢与NaHCO3反应生成的CO2气体,干扰试验,d选。
(6)根据碳元素守恒得:BaCO3—CO2—CaCO3,m(CaCO3)=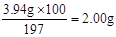 ,CaCO3的质量分数为
,CaCO3的质量分数为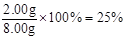 。
。
(7)B中的水蒸气、氯化氢等气体进入装置C中,质量差要大于实际产生CO2气体的质量。
点评:本题综合性强,突出对学生分析实验、理解实验、数据处理等能力的考察。
本题难度:一般
2、选择题 下列氯化物中,能直接利用金属与稀盐酸反应得到的是
A.FeCl3
B.CuCl2
C.MgCl2
D.AgCl
参考答案:C
本题解析:分析:盐酸具有弱氧化性,能与金属活动性顺序表中氢之前的金属发生置换反应,和变价金属反应只能生成低价盐.
解答:A、盐酸具有弱氧化性,和铁反应生成氯化亚铁,不是氯化铁,故A错误.
B、铜在金属活动性顺序表中氢之后,所以铜和盐酸不反应,故B错误.
C、镁在金属活动性顺序表中氢之前,所以镁和盐酸反应生成氯化镁,故C正确.
D、银在金属活动性顺序表中氢之后,所以银和盐酸不反应,故D错误.
故选C.
点评:本题考查了金属和稀盐酸的性质,难度不大,注意稀盐酸有弱氧化性,且氧化性是氢元素表现的,和变价金属反应只能生成低价态的氯化物.
本题难度:简单
3、选择题 常温下,能被浓硝酸钝化的金属是
A.Mg
B.Fe
C.Cu
D.Al
参考答案:BD
本题解析:常温下,能被浓硝酸钝化的金属是铁和铝,答案选BD。
点评:该题是基础性试题的考查,难度不大,有助于调动学生的学习兴趣和学习积极性,记住即可。
本题难度:简单
4、选择题 下列有关胶体的说法正确的是
A.胶体一定是混合物
B.胶体属于稳定体系
C.胶体与溶液的本质区别是有丁达尔效应
D.溶液呈电中性,胶体带有电荷
参考答案:A
本题解析:分析:A.根据混合物的概念:由多种物质组成的物质,如果是由分子构成时由多种分子构成的是混合物;
B.胶体是一种均一、介稳定的分散系;
C.胶体的分散质微粒直径大小是胶体区别于其它分散系的本质特征所在;
D.溶液和胶体均是呈电中性的.
解答:A.因为分散质粒子小于1nm的是溶液,大于100nm的是悬浊液或乳浊液,分散质粒子在1nm~100nm之间的分散系就是胶体,故A正确;
B.胶体较稳定,静止不容易产生沉淀,属于介稳体系,故B错误;
C.胶体区别于其它分散系的本质是胶体分散质微粒直径的大小,不是有丁达尔效应,故C错误;
D.溶液和胶体均不带电,是呈电中性的分散系,故D错误.
故选A.
点评:本题考查了胶体的性质,难度不大,注意知识的积累.
本题难度:困难
5、填空题 A.《物质结构与性质》
(1)前三周期元素中第一电离能最小的是? _______?(填元素符号),其基态原子的电子排布式为? _______?。第二周期非金属元素形成的氢化物中化学键极性最大的是? _______?
(填分子式),该物质在CCl4中的溶解度比在水中的溶解度? _______?(填“大”或“小”)。
(2)物质形成分子间氢键和分子内氢键对物质性质的影响有显著差异。根据下表数据,形成分子间氢键的物质是? _______?(填物质字母代号)。
(3)晶格能的大小:MgO? _______?NaCl,键能的大小:HBr? _______?HI。(填“>”、“=”或“<”)
(4)下列物质的熔点高低顺序,正确的是? _______?
A.金刚石>晶体硅>二氧化硅>碳化硅
B.CI4 > CBr4 > CCl4 > CH4
C.SiF4 > NaF > NaCl > NaBr
B《实验化学》
七水硫酸镁(MgSO4·7H2O)在印染、造纸和医药等工业上都有广泛的应用,利用化工厂生产硼砂的废渣-一硼镁泥可制取七水硫酸镁。硼镁泥的主要成分是MgCO3,还含有其他杂质(MgO、SiO2、Fe2O3、FeO、CaO、Al2O3、MnO等)。
表1?部分阳离子以氢氧化物形式完全沉淀时溶液的pH
沉淀物
| Al(OH)3
| Fe(OH)3
| Fe(OH)2
| Mn(OH)2
| Mg(OH)2
|
pH值
| 5.2
| 3.2
| 9.7
| 10.4
| 11.2
|
表2?两种盐的溶解度(单位为g/100g水)
温度 / ℃
| 10
| 30
| 40
| 50
| 60
|
CaSO4
| 0.19
| 0.21
| 0.21
| 0.20
| 0.19
|
MgSO4·7H2O
| 30.9
| 35.5
| 40.8
| 45.6
| /
|
硼镁泥制取七水硫酸镁的工艺流程如下:
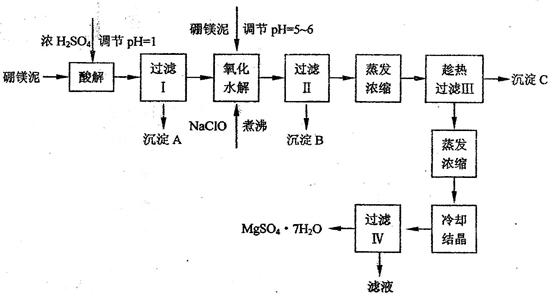
根据以上流程图并参考表格pH数据和溶解度数据,试回答下列问题:
(1)过滤I的滤液中加入硼镁泥,调节溶液的pH=5~6,再加入NaClO溶液加热煮沸,将溶液中的Mn2+氧化成MnO2,反应的离子反应方程式为? _______?。加热煮沸的主要目的是_? _______?。
(2)沉淀B中除MnO2、SiO2外还含有? _______?(填化学式)等物质。
(3)检验过滤Ⅱ后的滤液中是否含有Fe3+的实验方法是? _______?;
(4)沉淀C的化学式是? _______?。过滤II需趁热过滤的理由是? _______?
参考答案:A、(1)Na? 1S22S22P63S1? HF?小?
(2)B?
(3)>? >?
(4)B?
B、
(1)Mn2++ClO-+H2O=MnO2↓+2H++Cl-; 促进Al3+、Fe3+水解及Mn2+氧化成MnO2
(2)Fe(OH)3、 Al(OH)3
(3)取过滤II后的滤液1~2 ml于试管中,加入少量KSCN溶液,如果溶液不显红色,证明滤液中无Fe3+
(4)CaSO4·2H2O或CaSO4; 以防MgSO4在温度低时结晶析出。
本题解析:A (2)B的熔沸点明显高于A,且水中溶解度也大于A。(3)MgO的离子所带电量都大于NaCl,而离子半径又小于NaCl,所以离子键强度大于NaCl,晶格能大。HBr键长比HI短,键能大。
本题难度:一般