1、选择题 下列对于“摩尔”的理解正确的是
[? ]
A.摩尔是国际科学界建议采用的一种物理量
B.摩尔是物质的量的单位,简称摩,符号为mol
C.摩尔可以把物质的宏观数量与微观粒子的数量联系起来
D.国际上规定,0.012kg碳原子所含有的碳原子数目为1 mol
参考答案:B
本题解析:
A.摩尔是物质的量的单位,它不是一种物理量,A错误;
B.摩尔是物质的量的单位,简称摩,符号为mol,B正确;
C.物质的量可以把物质的宏观数量与微观粒子的数量联系起来,C错误;
D.国际上规定,0.012kg ?C-12所含有的碳原子数目为1 mol,D错误。
故选B.
本题难度:简单
2、选择题 现取m克铝镁合金与一定浓度的稀硝酸恰好完全溶解(假定硝酸的还原产物只有NO),向反应后的混合溶液中滴加amol/LNaOH溶液,当滴加到VmL时,得到沉淀质量恰好为最大值n克,则下列有关该实验的说法中正确的有(?)
①沉淀中氢氧根的质量为(n-m)克
②恰好溶解后溶液中的NO3-离子的物质的量为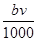 mol
mol
③反应过程中转移的电子数为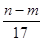 mol
mol
④生成NO气体的体积为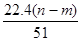 L
L
⑤与合金反应反应的硝酸的物质的量为(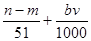 )mol
)mol
A.2项
B.3项
C.4项
D.5项
参考答案:C
本题解析:将化学问题抽象成为数学问题,通过计算和推理(结合化学知识),解决化学问题的能力。
沉淀量最大时生成的是氢氧化铝和氢氧化镁,根据质量守恒定律,其中镁、铝元素的质量等于合金的质量,所以沉淀中氢氧根的质量为(n-m)克是正确的;当沉淀最大是时,溶液中的溶质只有硝酸钠,硝酸根离子与钠离子的物质的量相等,也等于当作酸的硝酸的物质的量;所以恰好溶解后溶液中的NO3-离子的物质的量为(bv/1000)mol 也是正确的;OH-的物质的量等于溶液中阳离子所带的正电荷,也等于原子变为离子时所转移电子数,所以反应过程中转移的电子数为[(n-m)/17]mol也是正确的;转移的电子数再除以三就是做氧化剂的HNO3的物质的量,也等于NO的物质的量,但选项中没有说明状态,所以生成NO气体的体积为
[22.4(n-m)/51]L是错误的;参加反应的硝酸有两种作用,作酸的硝酸为(bv/1000)mol,作氧化剂的硝酸为(n-m)/51 mol,所以与合金反应的硝酸的物质的量为[(n-m)/51 + bv/1000]mol还是正确的。共有4项是正确的,正确答案是C。
本题难度:一般
3、选择题 在同温同压下,相同体积的甲、乙两种气体的质量比是17:14。若乙气体是CO,则甲气体可能是
A.H2S
B.HCl
C.NH3
D.Cl2
参考答案:A
本题解析:根据阿伏加德罗定律可知,等温等压等体积时,物质的量时相同的,所以质量之比时相应的摩尔质量之比,所以该气体的摩尔质量是28×17/14=34,所以是H2S,答案选A。
本题难度:一般
4、填空题 0.2mol NH3 质量为________,在标准状况下的体积为_______,所含氢原子的物质的量为_______,将其溶于水配制成1L溶液,所得溶液中溶质的物质的量浓度为________。
参考答案:3.4g;4.48L;0.6mol;0.2mol/L
本题解析:
本题难度:简单
5、填空题 实验室要配制100mL?2mol/L?NaOH溶液,请回答下列问题.
(1)配制过程中不需要使用的化学仪器有______(填选项的字母).
A.烧杯?B.100mL容量瓶?C.漏斗?D.胶头滴管?E.玻璃棒
(2)用托盘天平称取氢氧化钠,其质量为______g.
(3)实验开始前,需要检验容量瓶是否______.
(4)下列主要操作步骤的正确顺序是______(填序号).
①称取一定质量的氢氧化钠,放入烧杯中,用适量蒸馏水溶解;
②用胶头滴管向容量瓶中滴加蒸馏水至凹液面与刻度线相切;
③待冷却至室温后,将溶液转移到100mL?容量瓶中;
④盖好瓶塞,反复上下颠倒,摇匀;
⑤用少量的蒸馏水洗涤烧杯内壁和玻璃棒2~3次,洗涤液转移到容量瓶中.
(5)若实验过程中遇到下列情况,则会造成所配溶液的浓度偏低的是______.(填字母)
A.加水时越过刻度线
B.忘记将洗涤液加入容量瓶
C.容量瓶内壁附有水珠而未干燥处理
D.容量瓶用蒸馏洗涤后残留有少量的水
E.定容时俯视溶液的液凹面.
参考答案:(1)实验配制2mol/LNaOH溶液100mL,配制该溶液所需要的仪器有:托盘天平、药匙、烧杯、玻璃棒、100mL容量瓶、胶头滴管,故不需要的仪器为漏斗,故答案为:C;
(2)配制2mol/L的NaOH溶液100mL,氢氧化钠的物质的量为:0.1L×2mol/L=0.2mol,需氢氧化钠的质量为m=0.2mol×40g/mol=8.0g,故答案为:8.0;
(3)溶液配制最后需要,颠倒上下反复摇匀,故使用前需要检查容量瓶是否漏水,故答案为:漏水;
(4)配制步骤有计算、称量、溶解、冷却、移液、洗涤、定容、摇匀等操作,一般用托盘天平称量,用药匙取用药品,在烧杯中溶解(可用量筒量取水),用玻璃棒搅拌,冷却后转移到100mL容量瓶中,并用玻璃棒引流,洗涤烧杯与玻璃棒,并将洗涤液移入容量瓶,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加至凹液面与刻度线水平相切,盖好瓶塞,上下颠倒反复摇匀,故操作步骤的正确顺序为:①③⑤②④,故答案为:①③⑤②④;
(5)A.加水时越过刻度线,溶液的体积偏大,所配溶液的浓度偏低,故A符合;
B.忘记将洗涤液加入容量瓶,移入容量瓶内氢氧化钠的物质的量偏小,所配溶液的浓度偏低,故B符合;
C.溶液配制最后需加水定容,容量瓶内壁附有水珠而未干燥处理,对所配溶液浓度无影响,故C不符合;
D.溶液配制最后需加水定容,容量瓶用蒸馏洗涤后残留有少量的水,对所配溶液浓度无影响,故D不符合;
E.定容时俯视溶液的液凹面,液面在刻度线下方,溶液的体积偏大,所配溶液的浓度偏高,故E不符合;
故答案为:AB.
本题解析:
本题难度:简单