1、选择题 在常温下10mL pH=10的KOH溶液中,加入pH=4的一元酸HA溶液至pH刚好等于7(假设反应前后体积不变),则对反应后溶液的叙述正确的是
A.c(A-)=c(K+)
B.c(H+)=c(OH-)<c(K+)<c(A-)
C.V总≥20mL
D.V总无法确定其范围
参考答案:A
本题解析:pH=10的KOH溶液,c(OH-)=0.0001mol·L-1,pH=4的一元酸HA溶液若强酸,c(H+)=c(HA)=0.0001mol·L-1,混合后pH=7,则等体积混合;若酸为弱酸,c(HA)>0.0001mol·L-1,混合后pH=7时,应为醋酸和醋酸钾的混合溶液,其体积应小于10mL,即V总≤20mL,C和D不正确;又pH=7,则c(OH-)=c(H+),由电荷守恒可知,c(H+)+c(K+)=c(OH-)+c(A-),则c(A-)=c(K+),A正确;溶液中显性离子浓度大于隐性离子浓度,所以c(A-)=c(K+)>c(OH-)=c(H+),B不正确;选A.
本题难度:一般
2、选择题 我省盛产矿盐(主要成分是NaCl,还好有SO42-等其他可溶性杂质的离子)。下列有关说法正确的是
A.有矿盐生成食盐,除去SO42-最合适的实际是Ba(NO3)2
B.工业上通过电解氯化钠溶液制备金属钠和氯气
C.室温下,AgCl在水中的溶解度小于在食盐中的溶解度
D.用酚酞试液可鉴别饱和食盐水和饱和纯碱溶液
参考答案:D
本题解析:A、除去硫酸根的同时,引入了新的杂质硝酸根,错误;B、要得到钠和氯气需要电解熔融的NaCl,错误;C、增加氯离子的量,AgCl的沉淀溶解平衡向逆向移动,溶解度减小,错误;D、纯碱水解呈碱性,正确。
【考点定位】考查化学实验与化学反应基本原理,涉及除杂、沉淀溶解平衡、盐类水解等知识。
本题难度:一般
3、选择题 相同温度下等物质的量浓度的下列溶液中,c(NH4+)最大的是
A.NH4Cl
B.NH4HC03
C.NH4HS04
D.NH3·H20
参考答案:C
本题解析:
正确答案:C
A、NH4Cl强电解质,NH4+ 少量水解? B.NH4HC03强电解质,NH4+ 少量水解,HCO3―水解促进NH4+ 水解? C.NH4HS04强电解质,NH4+ 少量水解,H+ 抑制NH4+ 水解? D.NH3·H2O 弱电解质,少量电离,所以c(NH4+)最大的是C
本题难度:一般
4、选择题
A.c(NH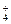 )>c(Cl-)>c(H+)>c(OH-)
)>c(Cl-)>c(H+)>c(OH-)
B.c(NH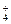 )>c(Cl-)>c(OH-)>c(H+)
)>c(Cl-)>c(OH-)>c(H+)
C.c(Cl-)>c(NH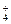 )>c(H+)>c(OH-)
)>c(H+)>c(OH-)
D.c(Cl-)>c(NH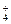 )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
参考答案:B
本题解析:pH=3的盐酸的浓度为10-3 mol·L-1,而pH=11的氨水的浓度大约为0.1 mol·
L-1远大于盐酸的浓度,故等体积混合后氨水过量,混合液中有
NH4Cl===NH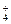 +Cl-?①
+Cl-?①
NH3·H2O(过量的) NH
NH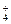 +OH-?②
+OH-?②
①式中c(NH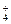 )=c(Cl-)而溶液中c(NH
)=c(Cl-)而溶液中c(NH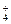 )总是①、②两式电离出的c(NH
)总是①、②两式电离出的c(NH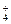 )之和,故c(NH
)之和,故c(NH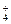 )>c(Cl-),又氨水过量溶液呈碱性故c(OH-)>c(H+),而氨水为弱电解质,故电离的c(OH-)一定小于c(Cl-)。
)>c(Cl-),又氨水过量溶液呈碱性故c(OH-)>c(H+),而氨水为弱电解质,故电离的c(OH-)一定小于c(Cl-)。
本题难度:简单
5、选择题 0.lmol/L的K2CO3溶液中,由于CO32-的水解,使得c(CO32-)<0.lmol/L。如果要使c(C O32-)更接近于0.lmol/L,可以采取的措施是(? )
A.加入少量盐酸
B.加入适量的水
C.加入适量的KOH
D.加热
参考答案:C
本题解析:A、加入少量盐酸,盐酸和碳酸根反应生成水和二氧化碳,碳酸根离子浓度减小,错误;B、加入水稀释会导致溶液中碳酸根离子浓度减小,错误;C、加入适量的KOH固体,会抑制碳酸根水解,使得碳酸根浓度接近0.1mol/L,正确;D、加热会促进碳酸根离子水解,导致离子浓度减小,错误。
本题难度:一般