1、选择题 如右图所示,将两烧杯中电极用导线相连,四个电极分别为Mg、Al、Pt、C。当闭合开关S后,电流表指针发生偏转,以下表述不正确的是
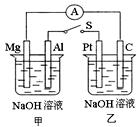
A.甲池发生了原电池反应
B.Mg是正极
C.乙烧杯中可以用乙醇代替氢氧化钠溶液,电流表仍会偏转
D.甲池pH逐渐减小
参考答案:CD
本题解析:略
本题难度:简单
2、选择题 某实验兴趣小组用如图所示装置实验,其中描述不合理的是
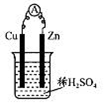
A.Zn为负极
B.H+向负极定向移动
C.化学能转化为电能
D.Cu电极反应:2H++2e-=H2↑
参考答案:B
本题解析:B:H+移动方向与电流相同,与电子方向相反。电子移动方向是Zn→Cu,所以H+应移向Cu极(正极)定向移动
本题难度:一般
3、选择题 下面能够构成原电池及电极反应式正确的是( )
A.Fe、Cu、浓硝酸溶液,负极反应式为:Fe-2e-═Fe2+
B.Al、Cu、稀硫酸,负极反应式为:Cu-2e-═Cu2+
C.Al、Mg、NaOH溶液,负极反应式为:Al+4OH--3e-═[Al(OH)4]-
D.Zn、Cu、乙醇,负极反应式为:Zn-2e-═Zn2+
参考答案:A.该装置符合原电池条件所以能构成原电池,铜易失电子作负极,电极反应式为Cu-2e-═Cu2+,铁作正极,故A错误;
B.该装置符合原电池构成条件所以能构成原电池,铝易失电子作负极,负极电极反应式为Al-3e-═Al3+,铜作正极,故B错误;
C.该装置符合原电池构成条件所以能构成原电池,铝易失电子作负极,负极电极反应式为Al+4OH--3e-═[Al(OH)4]-,故C正确;
D.该装置中不能自发的进行氧化还原反应,所以不能构成原电池,故D错误;
故选C.
本题解析:
本题难度:简单
4、计算题 按下图装置进行实验,并回答下列问题
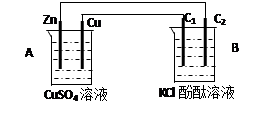
(1)判断装置的名称:B池为?
(2)铜极为______极,电极反应式为?
石墨棒C2附近发生的实验现象为?
(3)当C2极析出224mL气体(标准状态时,锌的质量变化(增加或减少)?g.
CuSO4溶液的质量变化了(增加或减少了)?g .
参考答案:(共9分,前3空每空1分,其余各2分)
(1) 电解池?(2)正? Cu2+ + 2e- = Cu?有气泡冒出,溶液变红?
(3)减少 0.65?增加 0.01
本题解析:(1)锌能和硫酸铜发生置换反应,所以根据装置结构特点可知,A是原电池,则B就是电解池。
(2)铜是正极,溶液中的铜离子得到电子,电极反应式是Cu2+ + 2e- = Cu。石墨棒C2和电源的负极相连,做阴极,溶液中的氢离子放电,同时破坏溶液中水的电离平衡,使阴极周围溶液显碱性,所以附近发生的实验现象为有气泡冒出,溶液变红。
(3)224ml气体是氢气,物质的量是0.01mol,则转移0.02mol电子,所以根据电子的得失守恒可知,消耗锌的物质的量是0.02mol÷2=0.01mol,质量是0.65g,即锌的质量减少0.65g。由于正极析出铜的质量是0.64g,所以溶液质量增加0.65g-0.64g=0.01g。
点评:该题是中等难度的试题,也是高考中的常见考点,试题基础性强,难易适中。主要是考查学生对电化学原理的了解掌握程度,有助于培养学生的逻辑思维能力,提高学生分析问题、特别是灵活运用基础知识解决实际问题的能力。
本题难度:一般
5、选择题 原电池结构如图所示,下列有关该原电池的说法正确的是
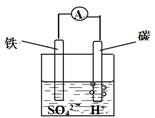
A.能将电能转换成化学能
B.电子从碳棒经外电路流向铁棒
C.碳棒发生氧化反应
D.总反应为 Fe+H2SO4= FeSO4+H2↑
参考答案:D
本题解析:根据原电池的原理,铁为原电池的负极,铁失去电子给硫酸电离出的H+,生成氢气,发生氧化反应,C错;原电池是将化学能转变成电能,A错;电子从铁棒经过外电路流向碳棒,B错;正极反应和负极反应相加得总反应为 Fe+H2SO4= FeSO4+H2↑。选D
点评:本道题目是高考中必考的知识点之一,即原电池的原理及其应用,其中判断电流方向,正、负极发生的化学反应式是常考的。
本题难度:一般