1、选择题 判断在下列装置中电流表能发生偏转的是(?)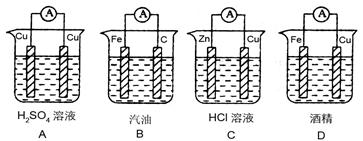
参考答案:C
本题解析:略
本题难度:简单
2、选择题 用铜片、锌片、稀H2SO4组成的原电池装置中,下列说法正确的是
A.铜片是正极
B.锌片是正极
C.铜电极失去电子
D.锌电极得到电子
参考答案:A
本题解析:
本题难度:简单
3、选择题 下列方案中.能够使反应Cu+2H2O═Cu(OH)2↓+H2↑发生的是( )
A.铜片作原电池的负极,碳棒作原电池的正极,氯化钠作电解质溶液
B.铜锌合金在潮湿的空气中发生电化学腐蚀
C.用铜片作阴、阳电极,电解硫酸钠溶液
D.用铜片作阴、阳电极,电解硫酸铜溶液
参考答案:金属铜和水之间发生的反应是非自发的氧化还原反应,应设计成电解池,在反应Cu+2H2O═Cu(OH)2↓+H2↑中,失电子的是金属铜,所以必须选择金属铜作阳极材料,其他导电的物质做阴极材料即可,在阴极上应该是水中的氢离子得电子的反应,可以选择硫酸钠等来做电解质.
A、原电池原理不能实现该非自发的氧化还原反应,故A错误;
B、铜锌合金在潮湿的空气中发生电化学腐蚀时,金属锌被腐蚀,铜被保护,故B错误;
C、用铜片作阴、阳电极,电解硫酸钠溶液,可以实现该反应的发生,故C正确;
D、以铜为电极电解硫酸铜溶液的原理是在阴极上析出金属铜,不会产生氢气,故D错误.
故选C.
本题解析:
本题难度:简单
4、选择题 下列说法不正确的是
A.纯锌与稀硫酸反应时,为加快速率可滴入少量硫酸铜溶液
B.常温下,反应C(s)+CO2(g)=2CO(g)不能自发进行,则该反应的△H>0
C.一定条件下,使用催化剂能加快反应速率并提高反应物的平衡转化率
D.对于同一个化学反应,无论是一步完成还是分几步完成,其反应的焓变相同
参考答案:C
本题解析:A:通过形成锌铜原电池加快产生氢气的速率,正确
B:由△S>0,低温下△G=△H-T△S>0,可知,△H>0,正确
C:催化剂不能使平衡移动,故不能提高反应物的平衡转化率,不正确
D:正确
答案为C
本题难度:一般
5、选择题 关于铜、锌和稀H2SO4构成的原电池的说法正确的是( )
A.锌是正极,铜是负极
B.H+在溶液里流向铜片
C.电流由锌流向铜
D.电子经外电路由锌流向铜
参考答案:A、该原电池中,锌是负极,铜是正极,故A错误;
B、氢离子向正极移动,即向铜片方向移动,故B正确;
C、电流由铜极沿导线流向锌极,故C错误;
D、外电路中,电子从负极锌沿导线流向正极铜,故D正确.
故选BD.
本题解析:
本题难度:一般