③____
参考答案:b? a≥33.6b?
本题解析:根据微粒的还原性的相对强弱顺序:I->Fe2+>Br-,所以Cl2通入溶液中,①首先是将I-氧化成I2,②剩余的Cl2才可能将Fe2+氧化成Fe3+,即:
①FeI2+Cl2 FeCl2+I2 FeCl2+I2
②2FeCl2+Cl2 2FeCl3 2FeCl3
总反应为:2FeI2+3Cl2 2FeCl3+2I2 2FeCl3+2I2
从以上反应方程式不难看出:
当n(Cl2)≤n(FeI2)时,只有I-被氧化,Fe2+的浓度保持不变;
当n(Cl2)>n(FeI2)时,I-全被氧化,Fe2+部分或全部被氧化。
故Fe2+的浓度有如下三种情况:
(1)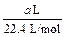 ≤b mol,a≤22.4b?c(Fe2+)=b mol/L ≤b mol,a≤22.4b?c(Fe2+)=b mol/L
(2)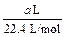 :b mol≥3∶2,a≥33.6b时,Fe2+全部被氧化,c(Fe2+)=0 :b mol≥3∶2,a≥33.6b时,Fe2+全部被氧化,c(Fe2+)=0
(3)22.4b≤a≤33.6b,Fe2+部分氧化c(Fe2+)=b-(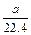 -b)×2 mol/L -b)×2 mol/L
本题难度:简单
2、填空题 请将5种物质:N2O、FeCl2、Fe (NO3)3、HNO3和FeCl3分别填入下面对应的横线上,组成一个未配平的化学方程式。
(1)_________+__________→__________+__________+__________+H2O(不需配平)
(2)反应过程中,N2O与FeCl2的物质的量之比为___________。
参考答案:(1)FeCl2? HNO3?Fe(NO3)3?FeCl3?N2O(5分)
(2)1:8(3分)
本题解析:所给的物质组合中,HNO3中氮元素化合价位于最高价,具有氧化性,对应还原产物为N2O,能将还原性的FeCl2氧化为FeCl3,根据氢原子守恒,水在生成物中,(1)FeCl2+HNO3 →Fe(NO3)3 + FeCl3+N2O+H2O,答案:FeCl2? HNO3?Fe(NO3)3?FeCl3?N2O;⑵反应过程中,生成1molN2O,转移的电子是8mol,需8molFeCl2,N2O与FeCl2的物质的量之比为1:8。答案:1:8
本题难度:一般
3、选择题 M2O7 x- 和S 2- 离子在酸性溶液中发生如下反应:M2O7x- +3S2- +14H+ =2M3+ +3S↓+7H2O,
则M2O7x- 离子中M元素的化合价是?(?)
A.+2
B.+3
C.+4
D.+6
参考答案:D
本题解析:首先由电荷守恒可知x=2,则容易计算出M2O72-中M的化合价为+6(本题也可根据化合价的升降守恒可求得结果)
本题难度:一般
4、选择题 三氟化氮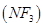 是微电子工业中优良的等离子刻蚀气体,它在潮湿的环境中能发生如下反应: 是微电子工业中优良的等离子刻蚀气体,它在潮湿的环境中能发生如下反应: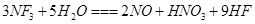 。下列有关该反应的说法正确的是 。下列有关该反应的说法正确的是
A.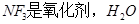 是还原剂 是还原剂
B.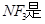 非极性分子,在潮湿空气中泄漏会看到红棕色气体 非极性分子,在潮湿空气中泄漏会看到红棕色气体
C.每消耗0.2mol氧化剂,可收集到5.418L气体
D.若生成1mol 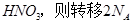 个电子 个电子
参考答案:D
本题解析:A、反应3NF3+5H2O=2NO+HNO3+9HF中只有N元素化合价发生变化,NF3既是氧化剂又是还原剂,错误;B、NF3结构类似于NH3,为极性分子,错误;C、0.3molNF3参加反应,有0.2mol化合价降低,为氧化剂,生成2molNO,在标准状况下为4.48L,错误;D、3molNF3生成1molHNO3,化合价由+3价升高到+5价,则转移2mol电子,数目为2NA,正确。
本题难度:一般
5、选择题 在反应3BrF3 + 5H2O = HBrO3 + Br2 +9HF + O2↑中,若有5molH2O做还原剂,被水还原的BrF3的物质的量为(?)
A.3mol
B.10/3mol
C.7.5mol
D.无法计算
参考答案:B
本题解析:略
本题难度:简单
|