| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学试题《盐类水解的原理》高频试题预测(2019年最新版)(二)
A.托盘天平 B.量筒 C.碱式滴定管 D.酸式滴定管 |
参考答案:
Ⅰ:N2(g)+3H2(g)=2NH3(g) ΔH=-92kJ·mol-1
Ⅱ:
【小题1】Cu2+水解产生Cu(OH)2是吸热反应,加热促进水解,故产生浑浊 应加入少量H2SO4 【小题2】2Al3++3S2-+6H2O = 2Al(OH)3↓+3H2S↑
III:
【小题1】溶液由浅绿色变为紫红色,且半分钟后不变则达到滴定终
【小题2】C
【小题3】ABDE
【小题4】50%
本题解析:Ⅰ:考查反应热的计算和热化学方程式的书写。反应热就是断键吸收的能量和相差化学键放出的能量的差值。因此该反应的反应热为3×436kJ/mol+9466kJ/mol-2×3×3916kJ/mol=-926kJ/mol,因此反应的热化学方程式为N2(g)+3H2(g)=2NH3(g) ΔH=-92kJ·mol-1。
Ⅱ:硫酸铜属于强酸弱碱盐,在溶液中铜离子水解生成氢氧化铜和硫酸。因为水解是吸热的,加热促使水解平衡向正反应方向移动,生成氢氧化铜沉淀,所以溶液会产生混浊。要想不产生混浊,则必须抑制铜离子的水解,因为水解显酸性,所以可以加入少量硫酸以抑制水解。
III:考查基本实验操作和有关计算。
(1)因为高锰酸钾溶液是显紫红色的,当溶液中的亚铁离子被完全氧化生成铁离子后,如果再加一滴酸性高锰酸钾溶液,则溶液的颜色将显紫红色,据此可判断终点。
(2)选项A中相当于稀释了标准液,则消耗标准液的体积将偏大,测定结果偏高。锥形瓶在滴定实验中是不允许用标准液润洗的,B的操作是正确的。滴定管的刻度自上而下是逐渐增大的,滴定前平视,读数不影响。滴定到终点后俯视,则读数将偏低,因此消耗的标准液体积偏低,测定结果偏低。选项D中相当于把这一滴液体计算到标准液中,实验测定结果偏高。
(3)样品需要称量和溶解并配制溶液,所以A、B、D均需要。酸性高锰酸钾溶液具有强氧化性,需要放在酸式滴定管中,D需要。
(4)根据实验可知消耗高锰酸钾是10.00ml,根据方程式可知10.0ml待测液中硫酸亚铁的物质的量是5×0.01L×0.1mol/L=0.005mol。所以FeSO4的质量分数为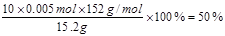 。
。
本题难度:困难
2、填空题 (10分)I、常温下在20mL0.1mol/L Na2CO3溶液中逐滴加入0.1mol/L HCl溶液40mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)物质的量分数(纵轴)随溶液pH变化的部分情况如图所示。
回答下列问题:
(1)在同一溶液中,H2CO3、HCO3-、CO32-(填:“能”或“不能”) 大量共存。
(2)已知在25℃时,CO32-水解反应的平衡常数(即水解常数用Kh表示)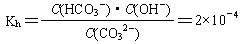
当溶液中c(HCO3-)
参考答案:
本题解析:
本题难度:困难
3、选择题 下列过程或现象与盐类水解无关的是
[? ]
A. 热的纯碱液用于去油污
B. 加热氯化铁溶液颜色变深
C. 饱和食盐水使甲基橙显黄色
D. 泡沫灭火器中的Al2(SO4)3溶液不能装在铁筒里
参考答案:C
本题解析:
本题难度:简单
4、选择题 下列过程或现象与盐类水解无关的是
A.将FeCl3溶于盐酸配制FeCl3溶液
B.加热稀醋酸溶液其pH降低
C.用低浓度铁盐溶液获得纳米氧化铁
D.小苏打溶液与AlCl3溶液混合产生气体和沉淀
参考答案:B
本题解析:A、氯化铁水解显酸性,加入盐酸,抑制水解,所以与水解有关,不选A;B、醋酸是弱酸,存在电离平衡,没有水解,所以选B;C、铁离子水解生成氢氧化铁,降低浓度,水解生成的物质少,所以与水解有关,不选C;D、小苏打是碳酸氢钠,与氯化铝反应,是双水解,与水解有关,不选D。
考点:盐类的水解。
本题难度:一般
5、选择题 下列各式中属于正确的水解反应的是( ? )
A.S2-+2H2O?H2S+2OH-
B.CH3COO-+H2O?CH3COOH+OH-
C.CH3COOH+H2O?CH3COO-+H3O+
D.CH3COOH+OH-=CH3COO-+H2O
参考答案:B
本题解析:
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点大全《化学实验安.. | |