| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学试题《盐类水解的原理》高频试题预测(2019年最新版)(八)
参考答案:AB 本题解析:A 对升高温度,水的离子积增大,所以c(H+)?c(OH-) > 1×10-14 本题难度:一般 3、选择题 在NH4Cl与NH3·H2O组成的混合液中,下列关系一定正确的是 |
参考答案:C
本题解析:A.在NH4Cl与NH3·H2O组成的混合液中,若NH3·H2O的电离作用大于NH4+的水解作用,则c(NH4+)>c(Cl—) ,若NH3·H2O的电离作用小于NH4+的水解作用,则c(NH4+)<c(Cl—) ,错误;B. 根据溶液的电荷守恒可知,若NH3·H2O的电离作用等于NH4+的水解作用,c(H+)=c(OH—) ,若NH3·H2O的电离作用不等于NH4+的水解作用,则c(H+)与c(OH—)不相等,错误;C.根据物料守恒可知,在任何情况下 c(NH4+)+c(NH3·H2O)>c(Cl—),正确;D. 根据电荷守恒可得:c(H+)+c(NH4+)>c(Cl—)+c(OH—) ,所以c(NH4+)<c(Cl—)+c(OH—),错误。
考点:考查溶液中离子浓度的大小比较的知识。
本题难度:一般
4、填空题 (1)常温下有PH分别为8、9、10的三种相同物质的量浓度的盐溶液NaX、NaY、NaZ,比较盐酸、HX、HY、HZ四种酸酸性由强到弱
(2)已知25°C时: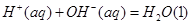
氢氟酸是一种弱酸,可用来刻蚀玻璃。20ml0.1mol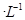 的氢氟酸与0.1mol/L
的氢氟酸与0.1mol/L
氢氧化钠溶液完全反应时放热aJ,写出氢氟酸电离的热化学方程式
参考答案:HCl 、HX、HY、HZ  △H==+(57.3-0.5a)kJ/mol
△H==+(57.3-0.5a)kJ/mol
本题解析:(1)酸越弱,相应的钠盐越容易水解,碱性越强,所以根据钠盐的pH的相对大小可知,盐酸、HX、HY、HZ四种酸酸性由强到弱HCl 、HX、HY、HZ。
(2)反应中生成水是0.002mol,所以生成1mol水放出的热量0.5akJ。则根据盖斯定律可知,1mol氢氟酸电离吸热是(57.3-0.5a)kJ,因此热化学方程式为 △H==+(57.3-0.5a)kJ/mol
△H==+(57.3-0.5a)kJ/mol
本题难度:一般
5、选择题 根据下列物质的化学性质,判断其应用错误的是 ( )
A.酒精能使蛋白质变性,可用于杀菌消毒
B.CaO能与SO2反应,可作工业废气的脱硫剂
C.明矾水解时产生具有吸附性的胶体粒子,可作净水剂
D.铝热反应中可得到铁,工业上可以利用该反应来大量生产铁
参考答案:D
本题解析:A、酒精可使蛋白质变性,所以可用于杀菌消毒,正确;B、氧化钙属于碱性氧化物,二氧化硫是酸性氧化物,二者反应生成亚硫酸钙,所以氧化钙用作工业废气的脱硫剂,正确;C、明矾中的铝离子水解生成氢氧化铝胶体,具有吸附作用,用作净水剂,正确;D、用铝热反应制取单质铁,不合理,该反应需要大量的难制取的铝,消耗大量的能量,错误,答案选D。
考点:考查物质的化学性质
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点大全《化学实验安.. | |