| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点总结《常见的化学电源》典型例题(十)
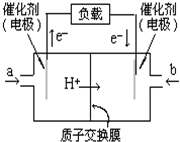 参考答案:A、依据图中电子流向分析,原电池中电子是从负极流向正极;电子流出的一端是负极,失电子发生氧化反应;所以a处是失电子的一端,通的是甲醇,故A错误; 本题解析: 本题难度:简单 3、选择题 如图是 参考答案:C 本题解析:略 本题难度:简单 4、选择题 据报道,美国正在研究的锌电池可能取代目前广泛使用的铅蓄电池,它具有容量大等优点,其电池反应为2Zn+O2=2ZnO,其原料为锌、电解液和空气,则下列叙述正确的是 参考答案:BD 本题解析: 本题难度:一般 5、填空题 如图所示,通电5 min后,第③极增重2.16 g,同时在A池中收集到标准状况下的气体224 mL,设A池中原混合液的体积为200 mL。 参考答案:(1) 正 ?阳 ?电解(镀)池 本题解析:(1)第③极增重2.16 g,说明该电极是阴极,则银电极是阳极,所以F是正极,E是负极,①②分别就是阴极和阳极。铜电极上的电极反应式为Ag++e-=Ag,反应中转移电子的物质的量为 本题难度:一般 |
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点大全《离子共存》.. | |