| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点归纳《水的电离平衡》考点强化练习(2019年押题版)(十)
参考答案:D 本题解析:0.1 mol·L-1的盐酸滴定10 mL 0.05 mol·L-1的NaOH溶液正好需5 mL 盐酸,现盐酸被稀释,其浓度小于0.10 mol·L-1,中和NaOH所需体积大于5 mL,选D。 本题难度:一般 2、选择题 25℃时pH=14的NaOH溶液与pH=1的H2SO4溶液混合,所得混合液的pH=12,则强碱与强酸的体积比为( ) |
参考答案:A
本题解析:考查pH的有关计算。所得混合液的pH=12,说明碱是过量的。溶液中氢离子的浓度是10-12mol/L,则OH-的浓度为0.01mol/L。所以有 ,解得V(碱)
,解得V(碱)
本题难度:一般
3、填空题 今有A.醋酸,B.盐酸, C.硫酸三种酸,请用三种酸的序号和“>”、“<”或“=”填空。
(1)在同体积,同pH的三种酸中,分别加入足量的NaHCO3粉末,在相同条件下产生CO2的体积由大到小的顺序是 。
(2)在同体积、同物质的量浓度的三种酸中,分别加入足量的NaHCO3粉末,在相同条件下产生CO2的体积由大到小的顺序是 。
(3)物质的量浓度均为0.1mol/L的三种酸溶液的pH由大到小的顺序是 ;如果取等体积的0.1mol/L的三种酸溶液,用0.1mol/L的NaOH中和,当恰好完全反应时,消耗NaOH溶液的体积由大到小的顺序是 。
参考答案:(1)a>b=c (2)c>a=b (3)a>b>c c>a=b
本题解析:(1)醋酸是一元弱酸,部分电离;一元强酸盐酸和二元强酸硫酸是完全电离的。当溶液的PH相等时,C(H+)相等,n(CH3COOH)>n(HCl)=2n(H2SO4)。最终可产生的H+的物质的量n(CH3COOH)>n(HCl)= n(H2SO4)。所以分别加入足量的NaHCO3粉末,在相同条件下产生CO2的体积由大到小的顺序是a>b=c。(2)在同体积、同物质的量浓度的三种酸中,也就是n(CH3COOH)=n(HCl)= n(H2SO4)。最终产生的H+的物质的量为n(H2SO4)>n(CH3COOH)=n(HCl)。故分别加入足量的NaHCO3粉末,在相同条件下产生CO2的体积由大到小的顺序是c>a=b。(3)H2SO4是二元强酸,完全电离;HCl是一元强酸也完全电离;CH3COOH一元弱酸,部分电离,当三者浓度相等时,H+的浓度物质的量浓度n(H2SO4)>n(HCl)>n(CH3COOH)。H+的浓度越大,溶液的酸性就越强,PH就越小。个浓度均是0.1mol/L的三种酸溶液的pH由大到小的顺序是a>b>c。如果取等体积的0.1mol/L的三种酸溶液,用0.1mol/L的NaOH中和,当恰好完全反应时,H2SO4能产生的H+的物质的量是HCl的二倍,消耗NaOH溶液的体积也是HCl的二倍。尽管盐酸是强酸,醋酸是弱酸,但由于二者的浓度相等,体积相等,物质的量就相等,中和碱的能力也相等。所以反应消耗NaOH的体积由大到小的顺序是c>a=b。
考点:考查醋酸、盐酸、硫酸三种酸在相同浓度或相同PH时与其它物质反应时的情况的知识。
本题难度:一般
4、选择题 在25℃的条件下,下列叙述正确的是
A.将稀氨水逐滴加入稀硫酸中,当溶液的pH=7时,c(SO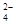 )= c(NH4+)
)= c(NH4+)
B.pH=3的醋酸溶液,稀释至原体积的10倍后pH=4
C.pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,溶液pH<7
D.向0.1mol·L-1的氨水中加入少量硫酸铵固体,则溶液中c(OH-) 增大
参考答案:C
本题解析:A选项氨水属于弱电解质,不能完全电离,而硫酸属于强电解质,能完全电离,因此A选项是错误的。B选项醋酸属于弱电解质。因此稀释至原来体积的10倍之后,PH应该小于4.D选项硫酸铵是属于强酸弱碱盐,显酸性,因此在氨水中加入硫酸铵,溶液的酸性会增强,因此,氢离子浓度会增大,从而氢氧根离子浓度会减小,因此D选项是错误的。
考点:考查弱电解质电离的相关知识点
本题难度:一般
5、选择题 常温下,将0.1 mol·L-1盐酸溶液与0.06 mol·L-1氢氧化钡溶液等体积混合,该混合溶液的pH等于( )
A.1.7
B.2.0
C.12.0
D.12.4
参考答案:C
本题解析: 根据题意可知:碱过量,所以酸碱混合后溶液显碱性,c(OH-)(后)=(0.06×2-0.1)÷2=0.01mol/L,根据水的离子积常数Kw=c(H+)· c(OH-)=1×10-14可得c(H+)=1×10-14÷0.01=10-12,所以pH=12,因此选项是C。
考点:考查酸碱混合溶液中溶液的pH计算的知识。
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学知识点总结《物质的量》.. | |