1、简答题 (1)有以下四种物质①22g二氧化碳;②8g氢气;③1.204×1024个氮气分子;④4℃时18g水;它们所含分子数最多的是______,所含原子数最多的是______,质量最大的是______,常温时体积最大的是______(填序号).
(2)等质量的二氧化硫和三氧化硫,它们的物质的量之比为______,所含的硫原子数之比为______,所含的氧原子数之比为______.
(3)147gH2SO4的物质的量是______;0.5molH2SO4的质量是______g,其中含有______molH,含有______molO;2molH2SO4中含有H2SO4分子数为______个,含氢原子数为______个.
参考答案:(1)①n(CO2)=22g44g/mol=0.5mol,②n(H2)=8g2g/mol=4mol,③n(N2)=1.204×10246.02×1023/mol=2mol,④n(H2O)=18g18g/mol=1mol,
则由n=NNA可知,物质的量越多,则分子数越多,所以所含分子数最多的是②;
四种气体所含原子数分别为①0.5mol×3=1.5mol,②4mol×2=8mol,③2mol×2=4mol,④1mo×3=3mol,则所含原子数最多的是②;
质量分别为①22g,②8g,③2mol×28g/mol=56g,④18g,则质量最大的是③;
由n=VVm可知,气体的物质的量越多,体积越大,则体积最大的是②,
故答案为:②;②;③;②;
(2)已知M(SO2)=64g/mol,M(SO3)=80g/mol,设质量都为mg,则等质量时,
n(SO2):n(SO3)=m64:m80=5:4;
所含的硫原子数之比等于二者物质的量之比,为5:4;
所含的氧原子数之比为5×2:4×3=5:6,
故答案为:5:4;5:4;5:6;
(3)n(H2SO4)=147g98g/mol=1.5mol;
0.5mol H2SO4的质量是0.5mol×98g/mol=49g,含有1molH,2molO;
2mol H2SO4中含有H2SO4分子数为2mol×NA/mol=2NA,含氢原子数为4NA,
故答案为:1.5mol;49;1;2;2NA;4NA.
本题解析:
本题难度:简单
2、选择题 将50mL 0.1mol/L NaCl和50mL 0.5mol/L CaCl2混合后,其溶液的体积变为二者的体积之和,则混合液中Cl-的物质的量浓度为( )
A.1mol/L
B.0.55mol/L
C.0.67mol/L
D.2mol/L
参考答案:B
本题解析:
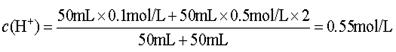
本题难度:简单
3、选择题 阿伏加德罗常数约为6.02×1023mol-1,下列叙述中错误的是
①12.4g 白磷晶体中含有的P-P键数是0.6×6.02×1023
②含0.2mol H2SO4的浓硫酸与足量铜反应,生成SO2的分子数为0.1×6.02×1023
③7.8g Na2S和Na2O2的混合物中含有的阴离子数大于0.1×6.02×1023
④2mol SO2和1mol O2在V2O5存在的条件下于密闭容器中加热反应后,容器内物质分子数等于2×6.02×1023
⑤2.9g 2CaSO4?H2O含有的结晶水分子数为0.02×6.02×1023
A.①②③④⑤
B.①③④⑤、
C.②③④⑤
D.③④⑤