1、选择题 铁片放人下列溶液中,反应时无气体放出,取出后铁片质量减轻,则该溶液是
A.稀H2SO4
B.浓盐酸
C.AgNO3 溶液
D.Fe2(SO4)3溶液
参考答案:D
本题解析:注意反应时无气体放出,且与该液体反应后,质量增加
本题难度:简单
2、选择题 向质量为30 g的Fe、Fe2O3混合物中加入250 mL 4 mol·L-1的稀硝酸恰好使混合物完全溶解,放出NO(标准状况)2.24 L,所得溶液中再滴加KSCN溶液,无血红色出现。若用与上述混合物中铁元素质量相等的铁屑和足量的稀硫酸充分反应,所得到的气体在标准状况下的体积为(? )
A.15.12 L
B.10.08 L
C.2.24 L
D.3.36 L
参考答案:B
本题解析:所得溶液中再滴加KSCN溶液,无血红色出现,说明生成的是硝酸亚铁。硝酸是1mol,NO是0.1mol,所以根据原子守恒可知,硝酸亚铁的物质的量是0.45mol,所以含有的铁是0.45mol,则生成氢气是0.45mol,标准状况下的体积是10.08L,答案选B。
本题难度:一般
3、填空题 室温下,单质A、B、C分别为固体、黄绿色气体、无色气体。在合适的反应条件下,它们可以按下面框图进行反应,又知E溶液是无色的。请回答:
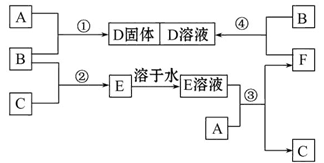
(1)A是_______、B是_______、C是_______ (请填化学式)。
(2)反应①的化学方程式为: ___________________________________。
(3)反应③的离子方程式为: _________________________________________。
(4)反应④的离子方程式为:___________________________________________。
参考答案:(1)Fe? Cl2? H2
(2)2Fe+3Cl2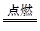 2FeCl3
2FeCl3
(3)2H++Fe=Fe2++H2↑
(4)2Fe2++Cl2=2Fe3++2Cl-
本题解析:本题的突破口是B为黄绿色气体。据中学所学知识可知,B为Cl2。结合B(Cl2)+C(无色气体)→E→E溶液,可推测C为H2,E为HCl。再结合:A(s)+B(Cl2) →D(s); E(溶液)+A(s) →C(H2)+F;F+B(Cl2) →D(溶液),可推测A为Fe,F为FeCl2,D为FeCl3。
本题难度:一般
4、选择题 将5.52gFeOJe2O3、CnO的混合物加入120mL 1.0mol/L H2SO4溶液中完全溶解,向所得溶液中逐滴加入1.5mol/L NaOH溶液至刚出现沉淀时,消耗NaOH溶液40mL;将等质量的原混合物用CO气体加热还原,则在该实验过程中CO失去电子的物质的量不可能是
A.0.06mol
B.0.12mol
C.0.18mol
D.0.20mol
参考答案:D
本题解析:与混合物反应的H+的物质的量为:0.12×1.0×2—1.5×0.04=0.18mol;
各氧化物与硫酸反应时,其中一个氧结构两个氢,所以混合物中氧元素的物质的量为0.09mol;
混合物与CO反应的本质是一个CO结合一个氧形成CO2,故最多可消耗CO为0.09mol,CO中的碳元素由+2价升高到+4价,故CO最多可失电子0.18mol
答案为D
本题难度:一般
5、选择题 铁是一种应用广泛的金属。下列有关铁的说法正确的是
A.铁与盐酸反应生成氯化铁和氢气
B.常温下铁在浓硫酸中钝化
C.铁在氧气中燃烧生成物为三氧化二铁
D.纯铁(块状)是黑色金属
参考答案:B
本题解析:.铁与盐酸反应生成氯化亚铁和氢气,A不正确;B正确,C不正确,铁在氧气中燃烧生成四氧化三铁。纯铁是银白色金属,D不正确,答案选B。
点评:该题是识记性知识的考查,难度不大。平时注意知识的积累和总结,并能灵活运用即可,有利于巩固基础,通过学生的应试能力。
本题难度:一般