1、选择题 某500mL溶液中含有0.1 mol Fe2+、0.2 mol Fe3+,加入0.2 mol铁粉,待Fe3+完全还原后,溶液中Fe2+的物质的量浓度为(假设反应前后体积不变)
[? ]
A.0.4mol·L-1
B.0.6mol·L-1
C.0.8mol·L-1
D.1.0mol·L-1
参考答案:C
本题解析:
本题难度:一般
2、选择题 与0.3mol H2O 中含有相同氢原子数的是下列哪种物质(? )。
A.0.3mol HNO3
B.3.612×1023个HNO3分子
C.0.1molH3PO4
D.0.2molCH4
参考答案:B
本题解析:0.3mol H2O 中含有相同氢原子数为0.6mol;四答案中含有相同氢原子数分别为0.3mol、0.6mol、0.3mol、0.8mol。
本题难度:一般
3、选择题 下列叙述正确的是
A.标准状况下,1molCCl4的体积约为22.4L
B.0℃、101KPa时,2g氢气的体积约为22.4L
C.通常状况下,22.4L CO2中所含分子数约为NA个
D.1mol气体的体积只有在标准状况下才约为22.4L
参考答案:B
本题解析:标准状况下,四氯化碳不是气体,不能适用于气体摩尔体积,A不正确;2g氢气是1mol,标准状况下的体积是22.4L,B正确;选项C不正确,因为不是在标准状况下;只要温度和压强满足一定条件,1mol气体的体积可以是22.4L,选项D不正确,答案选B。
本题难度:一般
4、选择题 设NA为阿伏伽德罗常数的值,下列说法中正确的是
A.常温下,16gO2和O3的混合气体中含有l.5NA个氧原子
B.常温下,1Llmol·L-1Na2CO3溶液中所含的CO32-为NA
C.58g乙烯和乙烷的混合气体中碳原子数目一定为4NA
D.常温常压下,足量的Fe在lmolCl2中充分燃烧,转移的电子数为2NA
参考答案:D
本题解析:A、16gO2和O3的混合气体中含有的O原子数为16g÷16g/mol×NA= NA,错误;B、CO32?离子发生水解反应,所以1Llmol·L-1Na2CO3溶液中所含的CO32-小于NA,错误;C、碳原子的物质的量介于58g÷28g/mol×2=4.1mol与58g÷30g/mol×2=3.9mol之间,因为乙烯和乙烷的物质的量之比不一定是1:1,所以碳原子数目一不定为4NA,错误;D、常温常压下,足量的Fe在lmolCl2中充分燃烧,Cl元素由0价降低为-1价,所以足量的Fe在lmolCl2中充分燃烧,转移的电子数为2NA,正确。
本题难度:一般
5、选择题 把含硫酸铵和硝酸铵的混合液a L分成两等份。一份加入含b mol NaOH的溶液并加热,恰好把NH3全部赶出;另一份需消耗c mol BaCl2才能使SO42-完全沉淀,则原溶液中NO3-的物质的量浓度为
A.
B.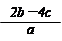
C.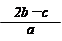
D.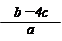
参考答案:B
本题解析:加入bmolNaOH产生bmolNH3,说明溶液中有NH4+为bmol。加入cmolBaCl2使SO42-全沉说明溶液中有SO42-cmol。混合溶液中除了有NH4+和SO42-还有NO3-根据电荷守恒可以求出n(NO3-)=(b-2c)mol,则c(NO3-)=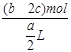 =
=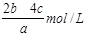 ,所以选B。
,所以选B。
点评:本题容易出现审题错误,把含硫酸铵和硝酸铵的混合液a L分成两等份,每份溶液的体积为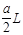 所以求硝酸根浓度时要除以
所以求硝酸根浓度时要除以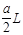 。
。
本题难度:一般