1、选择题 摩尔是
A.物质的量
B.物质的量的单位
C.物质的质量的单位
D.物质的数量的单位
参考答案:B
本题解析:略
本题难度:简单
2、选择题 下列说法中,正确的是( )
A.SO2的摩尔质量是64g
B.18g H2O在标准状况下的体积小于22.4L
C.在标准状况下,20mL NH3与60mL O2所含的分子数比为1:3。
D.将40g NaOH溶于1L水中,所得溶液的物质的量浓度为1mol/L
参考答案:BC
本题解析:
A.摩尔质量单位是g/ mol;B.18g H2O 是1mol H2O,标况下1mol气体体积为22.4L,标况下水为固体,1mol固体比1mol气体体积小;C.同温同压下体积之 比等于分子数之比;D.浓度小于1mol/L。
本题难度:一般
3、填空题 (6分)(1)在标准状况下,有下列物质:①4 g H2 ②33.6 L CH4 ③1 mol H2O ④3.01×1023个O2 ,其中含分子数最多的是(请在横线上填写序号,下同) ,含原子数最少的是 ,质量最大的是 ,体积最小的是 ;
(2)含0.4 mol Al3+的Al2(SO4)3中所含的SO42-的物质的量是 ;
(3)若1克H2O中含有a个氢原子,则阿伏加德罗常数用含a的代数式可表示为 。
参考答案:(1)①,④,②,③; (2)0.6mol; (3)9a mol-1。
本题解析:
试题解析:(1)①4gH2的n(H2)=2mol,N(H2)=2NA,N(H)=4NA,v(H2)=44.8L;②标准状况下33.6L CH4的n(CH4)=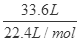 =1.5mol,N(CH4)=1.5NA,原子总数为5×1.5NA=7.5NA,质量为m(CH4)=1.5mol×16g/mol=24g;③1molH2O的分子数为N(H2O)=1NA,原子总数为3NA,体积约为18ml,质量为1mol×18g/mol=18g;④3.01×1023个O2的物质的量为n(O2)=0.5mol,原子总数为1NA,体积为11.2L,质量为0.5mol×32g/mol=16g;综上分析可知,含分子数最多的是①,含原子数最少的是④,质量最大的是②,体积最小的③,故答案为①;④;②;③;(2)Al2(SO4)3中n(Al3+):n(SO42-)=2:3,n(Al3+)=0.4mol,则n(SO42-)=0.6mol;(3)1g水的物质的量为:n(H2O)=
=1.5mol,N(CH4)=1.5NA,原子总数为5×1.5NA=7.5NA,质量为m(CH4)=1.5mol×16g/mol=24g;③1molH2O的分子数为N(H2O)=1NA,原子总数为3NA,体积约为18ml,质量为1mol×18g/mol=18g;④3.01×1023个O2的物质的量为n(O2)=0.5mol,原子总数为1NA,体积为11.2L,质量为0.5mol×32g/mol=16g;综上分析可知,含分子数最多的是①,含原子数最少的是④,质量最大的是②,体积最小的③,故答案为①;④;②;③;(2)Al2(SO4)3中n(Al3+):n(SO42-)=2:3,n(Al3+)=0.4mol,则n(SO42-)=0.6mol;(3)1g水的物质的量为:n(H2O)= =
=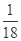 mol,
mol,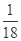 mol水中含有H原子的数目=
mol水中含有H原子的数目=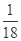 mol×2NA=a,则阿伏伽德罗常数NA=
mol×2NA=a,则阿伏伽德罗常数NA=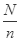 =
=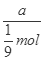 ==9amol-1。
==9amol-1。
考点:物质的量的计算
本题难度:一般
4、简答题 将一定量铜与足量浓硝酸充分反应,可以得到6.72L?NO2气体(气体体积在标准状况下测定).
(1)写出铜与浓硝酸反应化学方程式.标明电子转移的方向和数目.
(2)若反应后溶液体积为100mL,则所得溶液中Cu2+的物质的量浓度是多少?
(3)若改用排水法收集气体,则可收集到气体的体积为多少?
参考答案:(1)铜与浓硝酸反应:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,
答:

(2)根据得失电子守恒:n(Cu)×2=n(NO2)×1,则n(Cu)×2=n(NO2)×1=0.3mol,所以n(Cu)=0.15mol,所以铜离子浓度为 0.15mol0.1L=0.15mol/L,
答:所得溶液中Cu2+的物质的量浓度是0.15mol/L;
(3)根据反应:3NO2 +H2O═2HNO3+NO
? 0.3mol? 0.1mol
故最终剩下NO为 0.1mol,体积为2.24L.
答:可收集到气体的体积为2.24L.
本题解析:
本题难度:一般
5、计算题 把2.0 mol/L Fe2(SO4)3溶液和2.0 mol/L H2SO4等体积混合(假设混合后溶液的体积等于混合前溶液的体积之和)。计算:
(1)混合液中Fe3+的物质的量浓度 ;
(2)混合液中SO42—的物质的量浓度 ;
(3)向溶液中加入足量铁粉,经足够长时间后,铁粉有剩余,求此时溶液中FeSO4的物质的量浓度 。
参考答案:(1)c(Fe3+)=2 mol/L ;(2)c(SO42—)=4 mol/L ;(3)c(FeSO4)=4 mol/L
本题解析:设两个溶液的体积均为VL,(1)c(Fe3+)= 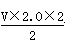 Vmol·L-1=2 mol/L;(2)c(SO42-)=
Vmol·L-1=2 mol/L;(2)c(SO42-)= 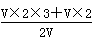 mol·L-1="4" mol/L;(3)铁粉足量,发生的反应:Fe+2Fe3+=3Fe2+,Fe+2H+=Fe2++H2↑,反应后溶液的溶质是FeSO4,根据S元素守恒,n(FeSO4)=3n(Fe2(SO4)3)+n(H2SO4)=3×V×2+V×2=8V,c(FeSO4)=8V/2Vmol·L-1=4mol·L-1。
mol·L-1="4" mol/L;(3)铁粉足量,发生的反应:Fe+2Fe3+=3Fe2+,Fe+2H+=Fe2++H2↑,反应后溶液的溶质是FeSO4,根据S元素守恒,n(FeSO4)=3n(Fe2(SO4)3)+n(H2SO4)=3×V×2+V×2=8V,c(FeSO4)=8V/2Vmol·L-1=4mol·L-1。
考点:考查物质的量、物质的量浓度的计算。
本题难度:困难