1、选择题 下列叙述中正确的是( )
A.反应2A(g)+B(g)=3C?(s)+D(g)在一定条件下能自发进行,说明该反应的△H>0
B.向沸水中滴加FeCl3饱和溶液制备Fe(OH)3胶体的原理是加热促进了Fe3+水解
C.25℃时,在Mg(OH)2悬浊液中加入少量NH4Cl固体后,c(Mg2+)增大
D.等体积,pH都为3的酸HA、HB分别与足量的Zn反应,HA放出的H2多,说明HA的酸性大于HB
参考答案:A、反应自发进行的判断依据是△H-T△S<0,反应的△S<0,反应在一定条件下能自发进行,说明△H<0,故A错误;
B、利用水解原理加热饱和的氯化铁溶液制备胶体,故B正确;
C、氯化铵溶液中铵根离子结合氢氧化镁沉淀溶解平衡中的氢氧根离子生成弱电解质,促进沉淀溶解,溶液中镁离子浓度增大,故C正确;
D、等体积,pH都为3的酸HA、HB分别与足量的Zn反应,HA放出的H2多,说明HA的酸性弱于HB,故D错误;
故选BC.
本题解析:
本题难度:一般
2、选择题 有关常温下pH均为3的醋酸和硫酸的说法正确的是
A.两种溶液中,由水电离出的氢离子浓度均为1×10-11 mol/L
B.分别加水稀释100倍后,两种溶液的pH仍相同
C.醋酸中的c(CH3COO-)和硫酸中的c(SO42-)相等
D.分别加入足量锌片,两种溶液生成H2的体积相同
参考答案:A
本题解析:醋酸和硫酸溶液中的水电离出的氢离子和氢氧根离子的浓度相等,水电离出的氢离子就等于溶液中的氢氧根离子,pH均为3时溶液中氢离子的溶度为 ,根据水的离子积可以得到
,根据水的离子积可以得到 ,A正确;加水稀释相同的倍数由于醋酸是弱酸稀释的过程中会电离出氢离子,而硫酸溶液中没有此过程,所以稀释相同的倍数时硫酸的PH变化较大,醋酸的PH变化较小,B错误;醋酸是一元酸,硫酸时二元酸当二者的PH相同时,溶液中
,A正确;加水稀释相同的倍数由于醋酸是弱酸稀释的过程中会电离出氢离子,而硫酸溶液中没有此过程,所以稀释相同的倍数时硫酸的PH变化较大,醋酸的PH变化较小,B错误;醋酸是一元酸,硫酸时二元酸当二者的PH相同时,溶液中 ,C错误;由于醋酸中还有没有电离的醋酸分子所以当加入足量的锌片后醋酸产生的氢气比硫酸多,D错误;所以答案选A。
,C错误;由于醋酸中还有没有电离的醋酸分子所以当加入足量的锌片后醋酸产生的氢气比硫酸多,D错误;所以答案选A。
本题难度:简单
3、填空题 有pH=1的盐酸、硫酸、醋酸三瓶溶液(用>、<、=填空,下同).
(1)设三种溶液的物质的量浓度依次为C1、C2、C3,则其关系是______.
(2)取相同体积的三种酸分别加入蒸馏水稀释到pH=3,需水的体积依次为V1、V2、V3,则其关系是______.
(3)完全中和体积和物质的量浓度均相同的Ba(OH)2溶液时,需三种酸的物质的量依次为n1、n2、n3,则其关系是______.
(4)取同体积的酸的溶液分别加入足量的锌粉,反应开始放出H2的速率依次为υ1、υ2、υ3,则其关系是______.
参考答案:(1)氯化氢和硫酸是强电解质,则盐酸溶液中C(H+)=C(HCl),硫酸溶液中C(H+)=12(H2SO4),醋酸是弱电解质且是一元酸,所以醋酸溶液中C(H+)<C(CH3COOH),pH相同的三种酸的物质的量浓度关系是C3>C1>C2;
故答案为:C3>C1>C2;
(2)稀释前后,盐酸和硫酸溶液中氢离子的物质的量不变,醋酸溶液中氢离子的物质的量增大,结合C=nV知,要使稀释后的溶液中pH仍相等,则需要水的体积大小关系是V3>V1=V2;
故答案为:V3>V1=V2;
(3)中和等物质的量的氢氧化钡溶液,则需要三种酸中提供的氢离子的物质的量相等,盐酸和醋酸是一元酸,硫酸是二元酸,要提供相同物质的量的氢离子,则盐酸和醋酸的物质的量相等,硫酸的物质的量是盐酸的一半即可,所以得n1=n3>n2,
故答案为:n1=n3>n2;
(4)pH=1的盐酸、硫酸、醋酸三种溶液中c(H+)=0.1mol/L,反应本质为Zn+2H+=Zn2++H2↑,氢离子浓度相同,故开始反应速率相同,即υ1=υ2=υ3,
故答案为:υ1=υ2=υ3.
本题解析:
本题难度:一般
4、选择题 已知25℃时有关弱酸的电离平衡常数:
弱酸化学式
| CH3COOH
| HCN
| H2CO3
|
电离平衡常数(25℃)
| 1.8×l0-5
| 4.9×l0-10
| K1=4.3×l0-7
K2=5.6×l0-11
|
?
则下列有关说法正确的是
A.向醋酸溶液加水稀释时,醋酸的电离平衡逆向移动。
B.等物质的量浓度的各溶液pH关系为:pH(NaCN)>pH(Na2CO3)>pH(CH3COONa)
C.a mol/L HCN溶液与b mol/L NaOH溶液等体积混合后,所得溶液中c(Na+)>c(CN-),则a一定大于b
D.相同浓度的CH3COONa和KCN溶液中c(Na+-)- c(CH3COO-)小于的c(K+) -c(CN-)
参考答案:D
本题解析:A、醋酸属于弱电解质,加水促进电离,电离平衡正向移动,A错误;B、根据电离平衡常数可知酸性强弱顺序为:CH3COOH>HCN>HCO3-,酸性越弱,对应钠盐中酸根离子水解程度越大,溶液的PH越大,等物质的量浓度的各溶液pH关系为:pH(Na2CO3)>pH(NaCN)>pH(CH3COONa),故B错误;C.氰化钠是强碱弱酸盐,要使其溶液呈中性,则酸的物质的量应该稍微大些,但溶液的体积未知,无法判断其浓度大小,故C错误;D、CH3COO-的水解程度小于CN-的水解程度,cCH3COO-)> c(CN-),所以D正确。
本题难度:一般
5、选择题 常温下,用0.1000 mol/L NaOH溶液分别滴定20.00 mL 0.1000 mol/L 盐酸和20.00 mL 0.1000 mol/L 醋酸溶液,得到2条滴定曲线,如下图所示。 若以HA表示酸,下列说法正确的是
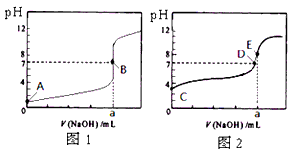
[? ]
A.滴定盐酸的曲线是图2
B.达到B、D状态时,两溶液中离子浓度均为c(Na+) = c(A-)
C.达到B、E状态时,反应消耗的n(CH3COOH)>n(HCl)
D.当0 mL< V(NaOH) <20. 00 mL时,对应混合溶液中各离子浓度由大到小的顺序均为 c(A-) >c(Na+)> c(H+) > c(OH-)
参考答案:B
本题解析:
本题难度:一般