1、选择题 下列物质中,既含有离子键又含有共价键的是
A.CH4
B.NaOH
C.SO2
D.H2O
参考答案:B
本题解析:考查化学键的判断。一般活泼的金属和活泼的非金属容易形成离子键,非金属元素的原子间容易形成共价键。据此判断A~D中含有的化学键分别是极性键、离子键和极性键、极性键、极性键,所以答案选B。
本题难度:一般
2、填空题 (16分)甲醇又称“木醇”或“木精”,沸点64.7℃,是无色有酒精气味易挥发的液体。甲醇有毒,误饮5~10mL能双目失明,大量饮用会导致死亡。甲醇是重要的化学工业基础原料和液体燃料,可用于制造甲醛和农药,并常用作有机物的萃取剂和酒精的变性剂等。
(1)工业上可利用CO2和H2生产甲醇,方程式如下:
CO2(g)+3H2(g)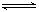 CH3OH(l)+H2O (g) △H=Q1kJ·mol-1
CH3OH(l)+H2O (g) △H=Q1kJ·mol-1
又查资料得知:①CH3OH(l)+1/2 O2(g)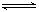 CO2(g)+2H2(g)△H=Q2kJ·mol-1
CO2(g)+2H2(g)△H=Q2kJ·mol-1
②H2O(g)=H2O(l) △H= Q3kJ·mol-1,则表示甲醇的燃烧热的热化学方程式为 。
(2)工业上可用CO和H2O (g) 来合成CO2和H2,再利用(1)中反应原理合成甲醇。某温度下,将1molCO和1.5molH2O充入10L固定密闭容器中进行化学反应:CO(g)+H2O(g)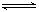 CO2(g)+H2(g) △H>0,当反应进行到10min时达到平衡,此时测得H2为0.6 mol。回答下列问题:
CO2(g)+H2(g) △H>0,当反应进行到10min时达到平衡,此时测得H2为0.6 mol。回答下列问题:
①0~10min内H2O(g)的平均反应速率为 。
②若想加快正反应速率的同时提高CO的转化率,可以采用的方法是 。
a.升高温度 b.缩小容器的体积
c.增大H2O (g)的浓度 d.加入适当的催化剂
③若保持温度容积不变再向其中充入1molCO和0.5molH2O(g),重新达到化学平衡状态时,此时平衡混合气体中H2的体积分数为 。
(3)甲醇燃料电池是符合绿色化学理念的新型燃料电池,下图是以甲醇燃料电池(甲池)为电源的电解装置。已知:A、B、C、D、E、F都是惰性电极,丙中为0.1 mol/L CuSO4溶液 (假设反应前后溶液体积不变),当向甲池通入气体a和b时,D极附近呈红色。回答下列问题:

① a物质是 ,A电极的电极反应式为 。
② 乙装置中的总化学反应方程式为 。
③ 当乙装置中C电极收集到224mL(标况下)气体时, 丙中溶液的pH= 。
参考答案:(16分)(每空2分)(1)CH3OH(l)+3/2 O2(g) = CO2(g)+2H2O(l) ΔH=(2Q1+3Q2+2Q3)kJ/mol
(2)① 6×10-3 mol·L-1·min-1 ②ac ③ 25%
(3)① CH3OH; CH3OH - 6e- + 8OH- = CO32- + 6H2O
② 2NaCl + 2H2O  2NaOH + Cl2↑+ H2 ↑ ③ 1
2NaOH + Cl2↑+ H2 ↑ ③ 1
本题解析:(1)已知反应:① CO2(g)+3H2(g)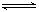 CH3OH(l)+H2O (g) △H=Q1kJ·mol-1,② CH3OH(l)+1/2 O2(g)
CH3OH(l)+H2O (g) △H=Q1kJ·mol-1,② CH3OH(l)+1/2 O2(g)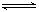 CO2(g)+2H2(g)△H=Q2kJ·mol-1,③ H2O(g)=H2O(l) △H= Q3kJ·mol-1,则根据盖斯定律可知2×①+3×②+2×③即可得到甲醇的燃烧热的热化学方程式为CH3OH(l)+3/2 O2(g) = CO2(g)+2H2O(l) ΔH=(2Q1+3Q2+2Q3)kJ/mol。
CO2(g)+2H2(g)△H=Q2kJ·mol-1,③ H2O(g)=H2O(l) △H= Q3kJ·mol-1,则根据盖斯定律可知2×①+3×②+2×③即可得到甲醇的燃烧热的热化学方程式为CH3OH(l)+3/2 O2(g) = CO2(g)+2H2O(l) ΔH=(2Q1+3Q2+2Q3)kJ/mol。
(2)①当反应进行到10min时达到平衡,此时测得H2为0.6 mol,则根据方程式可知消耗水蒸气是0.6mol,水蒸气浓度变化量是0.6mol÷10L=0.06mol/L,实验用氢气表示的反应速率为0.06mol/L÷10min=6×10-3 mol·L-1·min-1。
②a.正方应是吸热反应,则升高温度反应速率加快,平衡向正反应方向进行,CO的转化增大,a正确; b.反应前后体积不变,则缩小容器的体积压强增大,反应速率较加快,淡平衡不移动,CO转化率不变,b错误;c.增大H2O (g)的浓度正反应速率增大,平衡向正反应方向进行,则CO转化率增大,c正确; d.加入适当的催化剂反应速率加快,但平衡不移动,CO转化率不变,d错误,答案选ac。
③若保持温度容积不变再向其中充入1molCO和0.5molH2O(g),由于温度不变,则平衡常数不变,所以
CO(g)+H2O(g)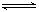 CO2(g)+H2(g)
CO2(g)+H2(g)
起始浓度(mol/L) 0.2 0.2 0 0
转化浓度(mol/L) x x x x
破坏你的(mol/L) 0.2-x 0.2-x x x
所以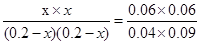
解得x=0.1
所以此时平衡混合气体中H2的体积分数为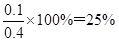
(3)①D极附近呈红色,这说明D电极周围产生氢氧根离子,即D电极是阴极氢离子放电,则A是负极。原电池中负极失去电子,则A通入的物质是CH3OH,电解质是氢氧化钾,则负极电极反应式为CH3OH - 6e- + 8OH-=CO32- + 6H2O。
②乙装置是电解饱和食盐水,则电解的总反应式为2NaCl + 2H2O  2NaOH + Cl2↑+ H2↑。
2NaOH + Cl2↑+ H2↑。
③当乙装置中C电极是阳极,氯离子放电生成氯气,如果收集到224mL(标况下)气体即氯气是0.01mol,则转移0.02mol电子,所以根据电子转移守恒可知丙装置中产生0.02mol氢离子,氢离子浓度是0.02mol÷0.2L=0.1mol/L,则丙中溶液的pH=1。
考点:考查盖斯定律应用、反应速率、平衡常数计算与应用、外界条件对平衡状态的影响以及电化学原理的应用等
本题难度:困难
3、填空题 (9分)研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
(1)NO2可用水吸收,也可用NH3处理,也可用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574 kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160 kJ·mol-1
若用标准状况下2.24L CH4还原NO2至N2整个过程中转移的电子总数为______(阿伏加德罗常数的值用NA表示),放出的热量为______kJ。
(2)已知:2SO2(g)+O2(g)  2SO3(g) ?H="-196.6" kJ·mol-1
2SO3(g) ?H="-196.6" kJ·mol-1
2NO(g)+O2(g) 2NO2(g) ?H="-113.0" kJ·mol-1
2NO2(g) ?H="-113.0" kJ·mol-1
(
参考答案:
本题解析:
本题难度:一般
4、填空题 (8分)用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。
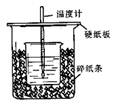
通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃用品是 。
(2)烧杯间填满碎纸条的作用是 。
(3)大烧杯上如不盖硬纸板,求得的中和热数值 (填“偏大、偏小、无影响”)
(4)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等、不相等”),所求中和热 (填“相等、不相等”),简述理由
(5)用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会 ;(填“偏大”、“偏小”、“无影响”)。
参考答案:17.(8分)(1)环形玻璃搅拌棒 (2)减少实验过程中的热量损失。 (3)偏小
(4)不相等;相等;因为中和热是指酸跟碱发生中和反应生成1molH2O所放出的热量,与酸碱的用量无关
(5)偏小;
本题解析:(1)根据量热计的构造可知该装置的缺少仪器是环形玻璃搅拌器,答案为:环形玻璃搅拌器;(2)中和热测定实验成败的关键是保温工作,大小烧杯之间填满碎纸条的作用是:减少实验过程中的热量损失,答案为:减少实验过程中的热量损失;(3)大烧杯上如不盖硬纸板,会导致热量散失,求得的中和热数值偏小;(4)反应放出的热量和所用酸以及碱的量的多少有关,若用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,生成水的量增多,所放出的热量偏高,但是中和热的均是强酸和强碱反应生成1mol水时放出的热,与酸碱的用量无关,所以用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液反应,测得中和热数值相等,答案为:不相等;相等;因为中和热是指酸跟碱发生中和反应生成1molH2O所放出的热量,与酸碱的用量无关;(5)氨水为弱碱,电离过程为吸热过程,所以氨水代替NaOH溶液反应,反应放出的热量小于57.3kJ,答案为:偏小.
考点:考查中和热的测定。
本题难度:一般
5、选择题 下列关于化学键的说法中,正确的是( )
A.只含有共价键的物质一定是共价化合物
B.单质分子中不一定含有化学键
C.NaCl溶于水破坏了离子键,乙醇溶于水破坏了共价键
D.CaCl2?中既有共价键又有离子键
参考答案:A.离子化合物中可以含共价键,如NaOH,故A错误;
B.单原子质分子中不存在化学键,如稀有气体,多原子分子中含有共价键,故B正确;
C.NaCl溶于水破坏了离子键,乙醇溶于水未破坏了共价键,故C错误;
D.氯化镁中只有镁离子和氯离子之间的离子键,故D错误;
故选B.
本题解析:
本题难度:一般