1、选择题 下列化合物①Fe3O4? ②AlCl3? ③FeCl2? ④FeCl3? ⑤NaHCO3? ⑥H2SiO3,其中不能通过化合反应制取的有
A.1种
B.2种
C.3种
D.4种
参考答案:A
本题解析:只有硅酸不能通过化合反应制取:
3Fe+202 Fe3O4? 2Al+3Cl2
Fe3O4? 2Al+3Cl2 2AlCl3? 3FeCl3+Fe=3FeCl2
2AlCl3? 3FeCl3+Fe=3FeCl2
2FeCl2+Cl2 2FeCl3? Na2CO3+CO2+H2O=2NaHCO3
2FeCl3? Na2CO3+CO2+H2O=2NaHCO3
答案为A
本题难度:困难
2、选择题 两种金属粉末的混合物16g,与足量稀硫酸反应后生成1g氢气,则这种混合物可能是
A.Mg,Al
B.Fe,Zn
C.Mg,Cu
D.Fe,Al
参考答案:CD
本题解析:分析:混合金属与酸反应生成氢气的质量为1g,物质的量为n(H2)=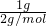 =0.5mol,根据M=
=0.5mol,根据M=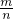 计算混合物的平均相对分子质量,进而判断金属的可能组成.
计算混合物的平均相对分子质量,进而判断金属的可能组成.
解答:n(H2)=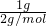 =0.5mol,
=0.5mol,
设金属的化合价都为+2价,Al的相对分子质量可看作27×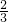 =18,则金属的物质的量也为0.5mol,
=18,则金属的物质的量也为0.5mol,
则混合物的平均相对原子质量为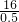 =32,则
=32,则
A.M(Mg)<24,M(Al)<32,二者的平均相对分子质量不可能为32,故A错误;
B.M(Fe)>32,M(Zn)>32,二者的平均相对分子质量不可能为32,故B错误;
C.M(Mg)<24,Cu与酸不反应,可看成无穷大,当Mg为12g是可生成1g氢气,故C正确;
D.M(Fe)>32,M(Al)<32,二者的平均相对分子质量可能为32,故D正确.
故选CD.
点评:本题考查混合物的计算,题目难度中等,可根据气体的物质的量计算混合物的平均相对原子质量,利用平均值法计算.
本题难度:困难
3、选择题 在加入Al能产生H2的溶液中一定能存在的离子是
A.HCO3-
B.CO32-
C.Na+
D.Mg2+
参考答案:C
本题解析:分析:在加入Al能产生H2的溶液,可能为酸或碱的溶液,则与氢离子或氢氧根离子反应的离子,一定不能存在,以此来解答.
解答:在加入Al能产生H2的溶液,可能为酸或碱的溶液,
A.HCO3-既能与酸反应又能与碱反应,则一定不存在,故A不选;
B.CO32-能与酸反应生成水和气体,则一定不存在,故B不选;
C.Na+既不能与酸反应又不能与碱反应,则一定存在,故C选;
D.Mg2+能与碱反应生成沉淀,则一定不存在,故D不选;
故选C.
点评:本题考查离子的共存问题,明确信息是解答本题的关键,并利用离子之间的反应来解答,难度不大.
本题难度:一般
4、选择题 下列电离方程式不正确的是
A.H2SO4═2H++SO42-
B.NaOH═Na++OH-
C.NaHCO3═Na++H++CO32-
D.AgNO3═Ag++NO3-
参考答案:C
本题解析:分析:强酸、强碱、大多数的盐为强电解质,在水中完全电离,利用遵循电荷守恒和质量守恒定律来分析,注意原子团不可拆分.
解答:A.硫酸为强电解质,则电离方程式为H2SO4═2H++SO42-,遵循电荷守恒和质量守恒定律,故A正确;
B.NaOH为强电解质,则电离方程式为NaOH═Na++OH-,遵循电荷守恒和质量守恒定律,故B正确;
C.NaHCO3为强电解质,碳酸氢根离子不可拆分,则电离方程式为NaHCO3═Na++HCO3-,故C错误;
D.AgNO3为强电解质,则电离方程式为AgNO3═Ag++NO3-,遵循电荷守恒和质量守恒定律,故D正确;
故选C.
点评:本题考查电离方程式的书写,注意电荷守恒和质量守恒定律、原子团、弱酸的酸根离子等即可解答,较简单.
本题难度:一般
5、选择题 某物质灼烧时,火焰呈黄色,下列判断中正确的是
A.该物质一定不含钾元素
B.该物质一定是金属钠
C.该物质一定是钠的化合物
D.该物质一定含钠元素
参考答案:D
本题解析:分析:焰色反应是某些金属或它们的化合物在无色火焰中灼烧时使火焰呈现特征的颜色的反应;某物质灼烧时,火焰呈黄色,说明是含钠元素的物质,可以是钠单质,也可以是含钠元素的化合物;
解答:A、金属K是在高温下用Na还原得到的,所以实验中用的K中会混有微量的Na,灼烧时火焰容易呈黄色,因此钾元素的焰色反应必须隔着钴玻璃观察为紫色火焰,故A错误;
B、焰色反应是钠元素的性质,可以是金属钠,也可以是含钠元素的化合物,故B错误;
C、焰色反应是钠元素的性质,可以是金属钠,也可以是含钠元素的化合物,故C错误;
D、该物质一定含有钠元素,故D正确;
故选D.
点评:本题考查了焰色反应的概念应用,理解焰色反应的实质是金属元素的性质.
本题难度:一般