1、选择题 下列离子反应方程式正确的是 (?)
A.铜粉与98.3%的硫酸加热下反应:Cu + 4H+ + SO42-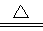 Cu2++ SO2↑+ 2H2O
Cu2++ SO2↑+ 2H2O
B.电解饱和食盐水:2Cl- +2H+ H2↑+C12↑
H2↑+C12↑
C.向氯化铝溶液中加入过量氨水:Al3++ 4NH3·H2O=[Al(OH)4]-+ 4NH4+
D.硫酸亚铁溶液中加入用硫酸酸化的过氧化氢溶液:2Fe2++2H++H2O2=2Fe3++2H2O
参考答案:D
本题解析:A选项,铜粉与98.3%的硫酸加热下反应Cu + 2H2SO4(浓)  Cu2++SO42-+ SO2↑+ 2H2O。浓硫酸主要以分子形式存在,要写成化学式形式。错误。B选项,电解饱和食盐水:2Cl-+2H2O
Cu2++SO42-+ SO2↑+ 2H2O。浓硫酸主要以分子形式存在,要写成化学式形式。错误。B选项,电解饱和食盐水:2Cl-+2H2O  H2↑+C12↑+2OH-。水是弱电解质,不能写成离子形式。错误。C选项,向氯化铝溶液中加入过量氨水:Al3++3NH3·H2O=Al(OH)3↓ + 3NH4+,一水合氨是弱碱,不能溶解氢氧化铝。错误。D选项,符合客观事实。正确。
H2↑+C12↑+2OH-。水是弱电解质,不能写成离子形式。错误。C选项,向氯化铝溶液中加入过量氨水:Al3++3NH3·H2O=Al(OH)3↓ + 3NH4+,一水合氨是弱碱,不能溶解氢氧化铝。错误。D选项,符合客观事实。正确。
本题难度:一般
2、选择题 (1)铜粉放入稀H2SO4中,加热后无明显现象,当加入KNO3?后,铜粉质量减小,溶液变蓝,同时气体逸出,该反应的离子方程式为 ?。(2)在含Cu+的酶的活化中心内,亚硝酸根离子(NO2-)可转化为NO,写出Cu+与亚硝酸根离子在酸性水溶液中反应的离子方程式?。
参考答案:方程式、离子方程式评分标准:
1.未配平或配平错误不得分;
2.配平正确,其它不全,扣1分 (如条件不全,缺“↑”等):
(6分)(1)3Cu+8H++2NO3-=3Cu2++4H2O+2NO↑(3分)
(2)Cu++2H++NO2-=Cu2++H2O+NO↑(3分)
本题解析:(1)铜是不活泼的金属,与稀硫酸不反应。由于在酸性条件下NO3-具有强氧化性,能和铜发生氧化还原反应生成硝酸铜、和水,反应的离子方程式为3Cu+8H++2NO3-=3Cu2++4H2O+2NO↑。
(2)在含Cu+的酶的活化中心内,亚硝酸根离子(NO2-)可转化为NO,这说明反应中NO2-得到电子,做氧化剂,因此Cu+失去电子,被氧化生成Cu2+,所以反应的离子方程式为Cu++2H++NO2-=Cu2++H2O+NO↑。
本题难度:一般
3、选择题 某二价金属的碳酸盐和碳酸氢盐的混合物与足量的盐酸反应,消耗H+和产生CO2的物质的量之比为5:4,则该混合物中碳酸盐与碳酸氢盐的物质的量之比为( )
A.1:3
B.2:3
C.3:4
D.4:5
参考答案:令碳酸盐和碳酸氢盐的物质的量分别为xmol、ymol,则:
RCO3~~~~2H+~~~~CO2,R(HCO3)2~~~~2H+~~~~2CO2,
1? 2? 1? 1? 2? 2
xmol? 2xmol? xmol? ymol? 2ymol?2ymol
所以(2xmol+2ymol):(xmol+2ymol)=5:4,
解得x:y=2:3.
故选B.
本题解析:
本题难度:简单
4、选择题 下列离子方程式书写正确的是
A.铁片插入稀硫酸中 2Fe+6H+=2Fe3++3H2↑
B.氢氧化镁与稀硫酸反应 H++OH-=H2O
C.向硝酸银溶液中加盐酸 AgNO3+Cl-=AgCl↓+NO3-
D.用氢氧化铝治疗胃酸(HCl)过多 Al(OH)3+3H+=Al3++3H2O
参考答案:D
本题解析:A不正确,生成物应该是硫酸亚铁和氢气;B不正确,氢氧化镁是难溶性物质,应该用化学式表示;硝酸银易溶、易电离的,应该用离子表示,则选项C不正确,答案选D。
点评:该题是高考中的高频题,属于中等难度的试题,侧重对学生能力的培养和训练。该题需要明确判断离子方程式正确与否的方法一般,即(1)检查反应能否发生。(2)检查反应物、生成物是否正确。(3)检查各物质拆分是否正确。(4)检查是否符合守恒关系(如:质量守恒和电荷守恒等)。(5)检查是否符合原化学方程式,然后灵活运用即可。该题有助于培养学生分析问题、解决问题的能力。
本题难度:一般
5、填空题 写出下列反应的离子方程式:
(1) 铝和氢氧化钾溶液反应?___;
(2) 硫酸铝和氨水的反应?________;
(3)二氧化硅和氢氧化钠溶液反应?____;
参考答案:(1)2Al+2OH-+2H2O=2AlO2-+3H2↑
(2) Al3++3NH3·H2O=Al(OH)3↓+3NH4+
(3) SiO2 + 2OH- = SiO3 2- + H2O
本题解析:根据教材知识做答。
点评:本题考查化学方程式和离子方程式的书写,题目难度不大,注意物质的性质和离子方程式的书写方法。
本题难度:一般