1、选择题 X、Y两元素的原子,当它们分别获得两个电子形成稀有气体元素原子的电子层结构时,X放出的能量大于Y放出的热量;Z、W两元素的原子,当它们分别失去一个电子形成稀有气体元素原子的电子层结构时,吸收能量W大于Z.则X、Y和Z、W分别形成的化合物中,离子化合物可能性最大的是( )
A.Z2X
B.Z2Y
C.W2X
D.W2Y
参考答案:A
本题解析:
本题难度:简单
2、简答题 氮、磷、砷是同族元素,该族元素单质及其化合物在农药、化肥等方面有重要应用.请回答下列问题.
(1)砷原子核外电子排布式为______.
(2)K3[Fe(CN)6]晶体中Fe3-与CN-之间的键型为______,该化学键能够形成的原因是______.
(3)NH4+中氮原子的杂化类型为______,NH4+的空间构型为______.
(4)已知:
| CH4 | SiH4 | NH3 | PH3
沸点(K)
101.7
161.2
239.7
185.4
分解温度(K)
873
773
1073
713.2
|
分析上表中四种物质的相关数据,请回答:
①CH4和SiH4比较,NH3和PH3比较,沸点高低的原因是______;
②CH4和SiH4比较,NH3和PH3比较,分解温度高低的原因是______;
结合上述数据和规律判断,一定压强下HF和HC1的混合气体降温时______先液化.
(5)电负性(用X表示)也是元素的一种重要性质,下表给出8种元素的电负性数值:
| 元素 | Na | Mg | Al | Si | P | S | Cl | K
电负性
0.9
1.2
1.5
1.8
2.1
2.5
3.0
0.8
|
请回答下列有关问题:
①估计钙元素的电负性的取值范围:______<X<______.
②经验规律告诉我们:当形成化学键的两原子相应元素的电负性差值大于1.7时,所形成的一般为离子键;当小于1.7时,一般为共价键.试推断AIC13中形成的化学键的类型及其理由是______.
参考答案:(1)As的原子序数为33,基态原子的电子排布式为1s22s22p63s23p63d104s24p3,
故答案为:1s22s22p63s23p63d104s24p3;
(2)K3[Fe(CN)6]晶体中Fe3+与CN-之间的化学键类型为配位键,Fe3+有空轨道,能接受孤对电子,CN-能提供孤对电子,所以能形成配位键,
故答案为:配位键;CN-能提供孤对电子,Fe3+能接受孤对电子(或Fe3+有空轨道);
(3)NH4+离子中有4个N-H键,N原子采取sp3杂化方式,没有孤对电子的排斥,为正四面体结构,
故答案为:sp3;正四面体;
(4)①因结构相似时,相对分子质量越大,分子间作用力越大,因此CH4的沸点低于SiH4;但氨气分子间还存在氢键,则NH3的沸点高于PH3,
故答案为:结构相似时,相对分子质量越大,分子间作用力越大,因此CH4的沸点低于SiH4;但氨气分子间还存在氢键,则NH3的沸点高于PH3;
②因非金属性C>Si,N>P,则气态氢化物的稳定性CH4>SiH4,NH3>PH3;稳定性强的物质分解需要的温度高,从键能上可知,C-H键的键能大于Si-H键的键能,
N-H键的键能大于P-H键的键能,因此分解温度CH4的分解温度高于SiH4,NH3的分解温度高于PH3;HF中含有氢键,沸点高于HCl,降温时HF先液化,
故答案为:C-H键的键能大于Si-H键的键能,N-H键的键能大于P-H键的键能,因此分解温度CH4的分解温度高于SiH4,NH3的分解温度高于PH3;HF;
(5)①同一周期从左至右,随原子序数的递增,原子半径递减,对电子的吸引能力渐强,因而电负性值递增;同族元素从上到下,随着原子半径的增大,元素电负性值递减,
即Ca的电负性介于Mg和K的电负性之间,所以钙元素的电负性的取值范围为0.8<X<1.2,
故答案为:0.8;1.2;
②AlCl3中氯与铝的电负性差值为1.5小于1.7,故AlCl3中化学键为共价键
?故答案为:共价键,因为AlCl3中氯与铝的电负性差值为1.5,小于1.7,故AlCl3中化学键类型为共价键.
本题解析:
本题难度:一般
3、简答题 原子序数由小到大排列的四种短周期元素X、Y、Z、W,四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Z、W位于同主族.
(1)W元素在周期表中的位置为______;写出Y元素原子的价电子排布式:______;
(2)由X、Z两元素可以组成A、B两种化合物,A在一定条件下可以分解成B,A的分子属于______(填“极性”、“非极性”)分子.
(3)一定条件下,Y的单质气体与X的单质气体充分反应生成6.8g?C气体(已知n(X):n(Y)=3:1)可放出18.44kJ热量,则该反应的热化学方程式为______.
(4)由X、Y、Z、W四种元素组成的一种离子化合物D
①已知1mol?D能与足量NaOH浓溶液反应生成标准状况下44.8L气体.写出加热条件下D与NaOH溶液反应的离子方程式______.
②又知D既能与盐酸反应,又能与氯水反应,写出D与氯水反应的离子方程式______.
(5?)X的单质与Z的单质在KOH的浓溶液中可以形成原电池,如果以金属M和金属N为惰性电极,在电池的M极通入X的单质气体,N极通入Z的单质气体,则M极的电极反应式为______.
参考答案:原子序数由小到大排列的四种短周期元素X、Y、Z、W,四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,则X为氢元素;Y、Z左右相邻,Z、W位于同主族,原子序数Y<Z<W,则三者的相对位置为
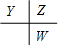
,令Y的原子序数为a,则Z的原子序数为a+1,W的原子序数为a+9,所以a+a+1+a+9=32-1,解得a=7,故X为氢元素,Y为氮元素,Z为氧元素,W为硫元素.
(1)W为硫元素,原子核外有16个电子,有3个电子层,最外层电子数为6,位于周期表中第三周期第VⅠA族;?Y为氮元素,原子核外有7个电子,核外电子排布式为1S22S22P3,氮原子价电子排布式?2S22P3.
故答案为:第三周期第VⅠA族;?2S22P3.
(2)X为氢元素,Y为氮元素,由X、Z两元素可以组成A、B两种化合物,A在一定条件下可以分解成B,则A为N2H4,B为NH3,N2H4分子中氮原子与氮原子之间形成N-N单键,每个N原子还形成2个N-H键,N原子有1对孤对电子对,N原子的杂化轨道数为4,N原子采取sp3杂化,呈三角锥,两个-NH2分别位于类似打开书页的页面内,与过氧化氢类似,分子不对称,为极性分子.
故答案为:极性.
(3)X为氢元素,Y为氮元素,一定条件下,Y的单质气体与X的单质气体充分反应生成6.8g?C气体,可放出18.44kJ热量,C为NH3,6.8gNH3的物质的量为6.8g17g/mol=0.4mol,所以生成2molNH3,放出的热量为18.44kJ×2mol0.4mol=92.2kJ,则该反应的热化学方程式为N2(g)+3H2(g)?

?2NH3?(g)△H=-92.2?kJ/mol.
故答案为:N2(g)+3H2(g)?

?2NH3?(g)△H=-92.2?kJ/mol.
(4)由X、Y、Z、W四种元素组成的一种离子化合物D,则D为硫酸形成的铵盐或亚硫酸形成的铵盐.
①D为硫酸形成的铵盐或亚硫酸形成的铵盐,1mol?D能与足量NaOH浓溶液反应生成标准状况下44.8L气体,该气体为氨气,物质的量为2mol,则D为硫酸铵或亚硫酸铵,加热条件下D与NaOH溶液反应的离子方程式为NH4++OH-??△?.?H2O+NH3↑.
故答案为:NH4++OH-??△?.?H2O+NH3↑.
②D既能与盐酸反应,又能与氯水反应,结合①可知D为亚硫酸铵,Cl2将SO32-氧化为SO42-,自身被还原为Cl-,
反应的离子方程式为SO32-+Cl2+H2O═SO42-+2Cl-+2H+.
故答案为:SO32-+Cl2+H2O═SO42-+2Cl-+2H+.
(5?)氢气与氧气在KOH的浓溶液中可以形成原电池,如果以金属M和金属N为惰性电极,在电池的M极通入X的单质气体,N极通入Z的单质气体,原电池负极发生氧化反应,则氢气在负极放电,正极反应还原反应,则氧气在正极放电,所以M极通氢气,N极通氧气,碱性条件下,氢气放电生成水,则M极的电极反应式为 H2+2OH--2e-═2?H2O.
故答案为:H2+2OH--2e-═2?H2O.
本题解析:
本题难度:一般
4、选择题 同一个原子的下列电子层中,能量最高的是( )
A.L层
B.K层
C.N层
D.M层
参考答案:C
本题解析:
本题难度:一般
5、选择题 某元素的原子核外有三个电子层,其最外层电子数是次外层电子数的一半,则此元素是( )
A.C
B.Si
C.S
D.C1
参考答案:B
本题解析:
本题难度:简单