|
高中化学知识点归纳《离子共存》典型例题(二)
2019-07-03 23:47:36
【 大 中 小】
|
1、选择题 室温下的溶液中,在强碱性溶液中不能大量共存的离子组是
A.Ba2+、Na+、NO3-、Br-
B.K+、Na+、SO32-、S2-
C.K+、Na+、AlO2-、SO42-
D.NH4+、Cu2+、Cl-、NO3-
|
参考答案:D
本题解析:D.铜离子在碱性条件下反应生成氢氧化铜沉淀,铵根离子在碱性条件下,反应生成氨气,故选D。
考点:离子共存。
本题难度:一般
2、填空题 弱电解质电离情况可以用电离度和电离平衡常数表示,表1是常温下几种弱酸的电离平衡常数(Ka)和弱碱的电离平衡常数(Kb),表2是常温下几种难(微)溶物的溶度积常数(Ksp)。
表1
酸或碱
| 电离平衡常数(Ka或Kb)
| CH3COOH
| 1.8×10-5
| HNO2
| 4.6×10-4
| HCN
| 5×10-10
| HClO
| 3×10-8
| NH3·H2O
| 1.8×10-5
|
?
表2
难(微)溶物
| 溶度积常数(Ksp)
| BaSO4
| 1×10-10
| BaCO3
| 2.6×10-9
| CaSO4
| 7×10-5
| CaCO3
| 5×10-9
|
?
请回答下面问题:
(1)表1所给的四种酸中,酸性最弱的是________________(用化学式表示)。下列能使醋酸溶液中CH3COOH的电离程度增大,而电离常数不变的操作是________(填序号)。
A.升高温度
B.加水稀释
C.加少量的CH3COONa固体
D.加少量冰醋酸
(2)CH3COONH4的水溶液呈________(选填“酸性”、“中性”或“碱性”),理由是_______________,溶液中各离子浓度大小关系是______。
(3)物质的量之比为1∶1的NaCN和HCN的混合溶液,其pH>7,该溶液中离子浓度从大到小的排列为______________________。
(4)工业中常将BaSO4转化为BaCO3后,再将其制成各种可溶性的钡盐(如BaCl2)。具体做法是用饱和的纯碱溶液浸泡BaSO4粉末,并不断补充纯碱,最后BaSO4转化为BaCO3。现有足量的BaSO4悬浊液,在该悬浊液中加纯碱粉末并不断搅拌,为使SO42—物质的量浓度不小于0.01 mol·L-1,则溶液中CO32—物质的量浓度应≥________ mol·L-1。
参考答案:(1)HCN B
(2)中性 水电离出的H+和OH-的浓度相等,CH3COONH4溶于水后,根据表1中的电离平衡常数,CH3COO-结合H+和NH4+结合OH-生成弱电解质的程度一样,导致水溶液中的H+和OH-浓度相等,溶液呈中性 c(NH4+)=c(CH3COO-)>c(OH-)=c(H+)
(3)c(Na+)>c(CN-)>c(OH-)>c(H+)
(4)0.26
本题解析:电离平衡常数越小,酸的酸性越弱,因此HCN酸性最弱;电离平衡常数只与温度有关,酸浓度越小,电离程度越大,加入CH3COONa和冰醋酸都会抑制CH3COOH的电离。由于醋酸与NH3·H2O的电离平衡常数相同,故NH4+、CH3COO-水解能力相同,CH3COONH4溶液呈中性,溶液中c(CH3COO-)=c(NH4+)>c(H+)=c(OH-)。NaCN和HCN混合溶液的pH>7,说明CN-的水解能力大于HCN的电离能力,故有c(Na+)>c(CN-)>c(OH-)>c(H+)。使SO42—浓度不小于0.01 mol·L-1则需使Ba2+浓度不大于? =1.0×10-8,所以CO32—浓度应大于等于? =1.0×10-8,所以CO32—浓度应大于等于?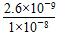 mol·L-1 mol·L-1
本题难度:一般
3、选择题 下列各组离子,能大量共存于同一溶液中的是(? )
A.K+、Na+、OH-、NO3-
B.H+、Ag+、Cl-、SO42-
C.CO32-、H+、Na+、NO3-
D.Ba2+、Ca2+、SO42-、OH-
参考答案:A
本题解析:离子间如果发生化学反应,则不能大量共存,反之是可以的。B中Ag+与Cl-、SO42-不能大量共存,C中CO32-与H+不能大量共存,D中Ba2+、Ca2+与SO42-、Ca2+与OH-不能大量共存,答案选A。
点评:该题是高考中的高频题,属于中等难度的试题,侧重对学生基础知识的训练和检验。有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力。该题需要明确离子不能大量共存的一般情况,即(1)能发生复分解反应的离子之间;(2)能生成难溶物的离子之间;(3)能发生氧化还原反应的离子之间;(4)能发生络合反应的离子之间(如 Fe3+和 SCN-);解决离子共存问题时还应该注意题目所隐含的条件,题目所隐含的条件一般有:(1)溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;(2)溶液的颜色,如无色时可排除 Cu2+、 Fe2+、Fe3+、MnO4-等有色离子的存在;(3)溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;(4)是“可能”共存,还是“一定”共存等。
本题难度:简单
4、填空题 (12分)
为减小和消除CO2对环境的影响,有科学家提出“绿色自由”构想。即先把空气吹人碳酸钾溶液,然后再把CO2从溶液中提取出来,并使之变为可再生燃料甲醇。“绿色自由”构想技术流程如下:
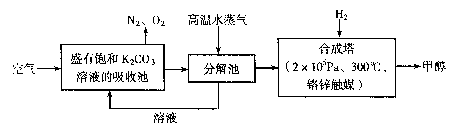
(1)写出分解池中反应的化学方程式?。
(2)在合成塔中,当有4.4kg CO2与足量H2完全反应,可放出热量4947 kJ,写出合成塔中反应的热化学方程式?。
(3)写出以氢氧化钾为电解质的甲醇燃料电池的负极反应式?。
当电子转移为?mol时,参加反应的氧气的体积是6.72L(标准状况下)。
(4)在体积为l L的密闭容器中,充人1mol CO2和3molH2在500°C下发生反应。有关物质的浓度随时问变化如下图所示。
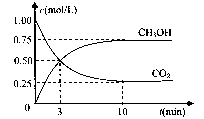
①从反应开始到平衡,H2的平均反应速率v(H2)=?。
②若其他条件不变,只将温度提高到800°C,再次达平衡时,n(CH3OH)/n(CO2)比值?(填“增大”、“减小”或“不变”)。
参考答案:
(1)2KHCO3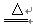 K2CO3+H2O+CO2↑ K2CO3+H2O+CO2↑
(2)CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H=-49.47kJ/mol
(3)CH3OH+8OH—6e-=CO2-3+6H2O;? 1.2mol
(4)①0.225mol/(L·min);②减小
本题解析:略
本题难度:一般
5、选择题 常温下,下列各组离子在指定溶液中不能大量共存的是( )
A.0.1mol?L-1NaOH溶液:K+、Na+、SO42-、CO32-
B.0.1mol?L-1NaHCO3溶液:K+、Ba2+、NO3-、Cl-
C.0.1mol?L-1FeCl3溶液:K+、NH4+、I-、SCN-
D.c(H+)/c(OH-)=1的溶液:Ca2+、Na+、ClO-、NO3-
参考答案:A.碱溶液中该组离子之间不反应,能大量共存,故A不选;
B.碱性溶液中该组离子之间不反应,能大量共存,故B不选;
C.Fe3+、I-离子之间发生氧化还原反应,Fe3+、SCN-结合生成络离子,不能大量共存,故C选;
D.c(H+)/c(OH-)=1的溶液,溶液显中性,该组离子之间不反应,能大量共存,故D不选;
故选C.
本题解析:
本题难度:一般
|