|
|
|
高中化学知识点归纳《离子共存》典型例题(八)
2019-07-03 23:47:36
【 大 中 小】
|
1、填空题 有M、N两种溶液,经测定这两种溶液中含有下列12种离子:Al3+、Cl-、Na+、K+、NO3-、OH-、Fe2+、AlO2-、CO32-、NH4+、SO42-、H+。
(1)完成下列表格中实验①的结论和实验②的实验内容以及现象:
实验内容以及现象
| 结论
| ①取少量N溶液滴加足量的硝酸钡溶液,无沉淀产生
| N中不含?离子
| ②
| 确定M溶液中含有Na+,不含K+
|  ③用pH试纸检测M溶液,pH试纸呈蓝色 ③用pH试纸检测M溶液,pH试纸呈蓝色
| ?
|
(2)根据①、②、③中的实验回答:
NO3-存在于________溶液中,理由是____________________________________;
Cl-存在于________溶液中,是根据_________________?确定的。
(3)根据(1)中的实验确定,M溶液中含有的离子为________________________。
参考答案:(1) ①CO32-、SO42-?②取少量M溶液进行焰色反应,焰色为黄色,再透过蓝色钴玻璃观察火焰颜色,不呈紫色。
(2)M?由于N溶液显酸性,又含有Fe2+,与NO3-不能大量共存N溶液呈电中性原则
(3)CO32-、SO42-、Na+、OH-、AlO2-、NO3-
本题解析:(1) ①取少量N溶液滴加足量的硝酸钡溶液,无沉淀产生,说明N溶液中不含CO32-、SO42-,因为CO32-、SO42-能和Ba2+发生复分解反应生成BaCO3和Ba SO4沉淀;②由结论M溶液中含有Na+,不含K+可知本题考查Na+、K+的检验实验操作:取少量M溶液进行焰色反应,焰色为黄色,再透过蓝色钴玻璃观察火焰颜色,不呈紫色。(2)由(1)①知N溶液中不含CO32-、SO42-,则CO32-、SO42-在M溶液中,与CO32-不能大量共存的Fe2+、Al3+在N溶液中;由②知Na+在M溶液中,K+在N溶液中;由③用pH试纸检测M溶液,pH试纸呈蓝色,说明M溶液存在大量OH-,则与OH-不能大量共存的NH4+、H+存在于N溶液中,与H+不能大量共存的AlO2-在M溶液中;由于N溶液中含有H+、Fe2+,不能含有NO3-,因硝酸能把Fe2+氧化为Fe3+,NO3-在M溶液中;根据电中性原则Cl-在N溶液中。综上所述,N溶液中含有H+、Fe2+、、Al3+、K+、NH4+、Cl-,M溶液中含有CO32-、SO42-、Na+、OH-、AlO2-、NO3-。
本题难度:一般
2、选择题 在强酸性的无色溶液中能大量共存的离子组是
A. 、Mg2+、 、Mg2+、 、Cl- 、Cl-
B.Ba2+、K+、OH-、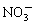
C.Al3+、Cu2+、 、Cl- 、Cl-
D.Na+、Ca2+、Cl-、CH3COO—
|
参考答案:A
本题解析:强酸性的溶液不可能大量存在OH-,B错;溶液无色,Cu2+是蓝色离子C错;强酸性溶液有大量的H+,CH3COO—会与H+结合生成CH3COOH ,D错,选A。
考点:离子大量共存。
本题难度:一般
3、填空题 某无色待测液中可能含有Ag+、Fe3+、K+、Ba2+、NH4+等阳离子。某同学进行如下实验:
I.加入过量的稀盐酸,有白色沉淀生成。
II.过滤,取少许滤液,向其中加入过量的稀硫酸,又有白色沉淀生成。
III.另取少量步骤II中的滤液,加入NaOH溶液至溶液呈碱性,加热,可产生使湿润的红色石蕊试纸变蓝色的气体。
(1)待测液中一定含有的离子是__________,一定不含有的离子是___________。
(2)步骤III中产生气体的离子方程式为__________________。
参考答案:(1)Ag+、Ba2+、NH4+?Fe3+(2)NH4++OH— NH3↑+H2O NH3↑+H2O
本题解析:根据题意知,溶液为无色,而Fe3+?在水溶液呈现棕黄色,故一定没有?Fe3+;根据Ⅰ知,加入过量的稀盐酸,有白色沉淀生成,溶液中一定有?Ag+;根据Ⅱ知,加入过量的稀硫酸,又有白色沉淀生成,滤液显酸性,溶液中一定有?Ba2+;根据Ⅲ知,加入NaOH溶液至溶液呈碱性,加热,可产生使湿润的红色石蕊试纸变蓝色的气体,溶液中一定有?NH4+;根据上述分析知,(1)待测液中一定含有的离子是?Ag+、Ba2+、NH4+;?一定不含有的离子是Fe3+;(?3)铵盐和氢氧化钠反应离子方程式为NH4++OH— NH3↑+H2O 。 NH3↑+H2O 。
本题难度:一般
4、选择题 下列各组的离子,能在溶液中大量共存的是( )
A.Na+ 、H+、SO42-、HCO3-
B.Cu2+、SO42-、Ba2+、Cl-
C.Na+、 K+、Cl-、 NO3-
D.Fe2+、NO3-、Cl-、H+、
|
参考答案:C
本题解析:A不能,氢离子与碳酸氢根离子不能共存.
B不能,钡离子与硫酸根离子不能共存.
C可以.
D不能,硝酸根离子在氢离子存在的情况下能表现出强氧化性,可以将+2价铁离子氧化成+3价.
本题难度:一般
5、填空题 (14分)常温下,将某一元酸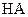 和
和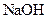 溶液等体积混合,混合前两种溶液的浓度和混合后所得溶液的
溶液等体积混合,混合前两种溶液的浓度和混合后所得溶液的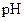 如下表(设混合后溶液体积变化忽略不计):
如下表(设混合后溶液体积变化忽略不计):
实验编号
| 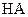 物质的量浓度 物质的量浓度
(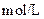 ) )
| 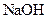 物质的量浓度 物质的量浓度
(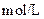 ) )
| 混合溶液的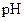
|
甲
| 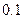
| 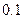
| 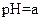
|
乙
| 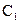
| 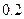
| 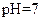
|
丙
| 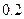
| 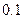
| 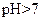
|
丁
| 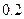
| 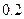
| 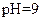
|
请回答;
(1)仅依据甲组数据分析,
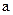
的取值范围为
??。
(2)从乙组情况分析,
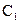
是否一定等于
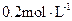 ?
??(选填“是”或“否”)。若
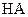
?为弱酸,计算出该混合溶液达平衡时
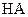
电离常数
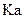
的近似值是
??(用含
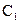
代数式表示)。
(3)丙组混合溶液
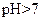
的原因是
?,该组混合溶液中离子浓度的大小关系是
?。
(4)若把某离子水解的物质的量占某离子总物质的量的百分数叫做“水解度”,依据丁组数据,推知
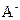
在该条件下的水解度是
?,该溶液中,水电离出的
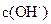
是
?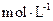
。
参考答案:(1)pH≥7(2分)(2)否(2分)? 10-8/(0.5C1-0.1)(2分)
(3)混合溶液中A-的水解程度大于HA的电离程度(2分)
c(Na+)>c(A-)>c(OH-)>c(H+)(2分)
(4)0.01% (2分)1×10-5(2分)
本题解析:略
本题难度:一般
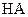 和
和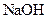 溶液等体积混合,混合前两种溶液的浓度和混合后所得溶液的
溶液等体积混合,混合前两种溶液的浓度和混合后所得溶液的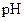 如下表(设混合后溶液体积变化忽略不计):
如下表(设混合后溶液体积变化忽略不计):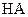 物质的量浓度
物质的量浓度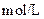 )
)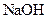 物质的量浓度
物质的量浓度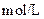 )
)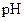
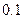
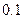
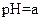
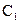
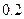
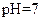
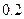
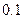
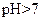
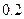
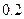
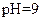
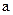 的取值范围为??。
的取值范围为??。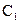 是否一定等于
是否一定等于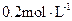 ??(选填“是”或“否”)。若
??(选填“是”或“否”)。若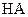 ?为弱酸,计算出该混合溶液达平衡时
?为弱酸,计算出该混合溶液达平衡时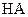 电离常数
电离常数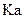 的近似值是??(用含
的近似值是??(用含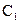 代数式表示)。
代数式表示)。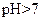 的原因是?,该组混合溶液中离子浓度的大小关系是?。
的原因是?,该组混合溶液中离子浓度的大小关系是?。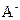 在该条件下的水解度是?,该溶液中,水电离出的
在该条件下的水解度是?,该溶液中,水电离出的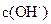 是?
是?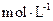 。
。