1、填空题 (5分)化学电池分为?① ,②,③,其中碱性锌锰电池属于④?,铅蓄电池属于⑤?。
2、选择题 燃料电池是一种新型电池,下列有关燃料电池的说法中,正确的是
[? ]
①优点之一是能量转换率高 ②优点之二是无污染 ③缺点之一是需要持续地补充燃料
④缺点之二是技术问题有待改进,尚朱广泛使用
A.①②③④
B.只有①②
C.只有②③
D.只有②
3、简答题 Ag2O2是银锌碱性电池的正极活性物质,可通过下列方法制备:在KOH加入适量AgNO3?溶液,生成Ag2O沉淀,保持反应温度为80,边搅拌边将一定量K2S2O8溶液缓慢加到上述混合物中,反应完全后,过滤、洗涤、真空干燥得到固体样品.反应方程式为
2AgNO3+4KOH+K2S2O8
Ag2O2↓+2KNO3+2K2SO4+2H2O
回答下列问题:
(1)上述制备过程中,检验洗剂是否完全的方法是______.
(2)银锌碱性电池的电解质溶液为KOH溶液,电池放电时正极的Ag2O2?转化为Ag,负极的Zn转化为K2Zn(OH)4,写出该电池反应方程式:______.
(3)准确称取上述制备的样品(设仅含Ag2O2和Ag2O)?2.558g,在一定的条件下完全分解为Ag?和O2,得到224.0mLO2(标准状况下).计算样品中Ag2O2的质量分数(计算结果精确到小数点后两位).
4、填空题 能源短缺是人类面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列两种反应合成甲醇:
反应I:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH1
CH3OH(g)+H2O(g) ΔH1
反应II:CO(g)+2H2(g) CH3OH(g) ΔH2
CH3OH(g) ΔH2
上述反应符合“原子经济”原则的是__________(填“Ⅰ”或“Ⅱ”),
(2)下表所列数据是反应Ⅱ在不同温度下的化学平衡常数(K)
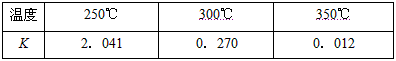
①由表中数据判断ΔH2_______0(填“>”、“<”或“=”),
②若容器容积不变,下列措施可增加甲醇产率的是______________,
A.升高温度
B.将CH3OH(g)从体系中分离
C.使用合适的催化剂
D.充入He,使体系总压强增大
E.按原比例再充入CO和H2
③某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)=
0.2mol·L-1,则CO的转化率为____________,此时的温度为____________(从上表中选择);
(3)某实验小组依据甲醇燃烧的反应原理,设计如图所示的原电池装置。
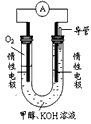
①该电池工作时,OH-向_______极移动(填“正”或“负”),
②该电池正极的电极反应式为___________________。
5、选择题 下列有关说法正确的是
A.铅蓄电池放电时,正极和负极的电极质量均增大
B.反应Cl2(g)+H2O(1)=HCl(aq)+HClO(aq)在常温下能自发进行,则该反应的△H>0
C.加热Fe2(SO4)3溶液,Fe3+的水解程度和溶液的pH均增大
D.C2H5Br水解生成乙醇(△H>0),加入少量NaOH浓溶液并加热,该化学反应速率增大其平衡常数不变