1、填空题 (5分)化学电池分为?① ,②,③,其中碱性锌锰电池属于④?,铅蓄电池属于⑤?。
参考答案:①一次电池,②二次电池,③燃料电池,④一次电池,⑤二次电池。(各1分共5分)
本题解析:化学电池按工作性质可分为:一次电池(原电池);二次电池(可充电电池);铅酸蓄电池;燃料电池。其中:一次电池可分为:糊式锌锰电池、纸板锌锰电池、碱性锌锰电池、扣式锌银电池、扣式锂锰电池、扣式锌锰电池、锌空气电池、一次锂锰电池等。二次电池可分为:镉镍电池、氢镍电池、锂离子电池、二次碱性锌锰电池等。铅酸蓄电池可分为:开口式铅酸蓄电池、全密闭铅酸蓄电池。
点评:本题考查的是化学电池的分类,题目是是识记类型的题目,记住就会做。化学电池(原电池)是利用两个电极之间金属性的不同,产生电势差,从而使电子的流动,产生电流.又称非蓄电池,是电化电池的一种,其电化反应不能逆转,即是只能将化学能转换为电能,简单说就即是不能重新储存电力,与蓄电池相对。
化学电池按工作性质可分为:一次电池(原电池);二次电池(可充电电池);铅酸蓄电池;燃料电池。其中:一次电池可分为:糊式锌锰电池、纸板锌锰电池、碱性锌锰电池、扣式锌银电池、扣式锂锰电池、扣式锌锰电池、锌空气电池、一次锂锰电池等。二次电池可分为:镉镍电池、氢镍电池、锂离子电池、二次碱性锌锰电池等。铅酸蓄电池可分为:开口式铅酸蓄电池、全密闭铅酸蓄电池。
本题难度:简单
2、选择题 燃料电池是一种新型电池,下列有关燃料电池的说法中,正确的是
[? ]
①优点之一是能量转换率高 ②优点之二是无污染 ③缺点之一是需要持续地补充燃料
④缺点之二是技术问题有待改进,尚朱广泛使用
A.①②③④
B.只有①②
C.只有②③
D.只有②
参考答案:A
本题解析:
本题难度:简单
3、简答题 Ag2O2是银锌碱性电池的正极活性物质,可通过下列方法制备:在KOH加入适量AgNO3?溶液,生成Ag2O沉淀,保持反应温度为80,边搅拌边将一定量K2S2O8溶液缓慢加到上述混合物中,反应完全后,过滤、洗涤、真空干燥得到固体样品.反应方程式为
2AgNO3+4KOH+K2S2O8
Ag2O2↓+2KNO3+2K2SO4+2H2O
回答下列问题:
(1)上述制备过程中,检验洗剂是否完全的方法是______.
(2)银锌碱性电池的电解质溶液为KOH溶液,电池放电时正极的Ag2O2?转化为Ag,负极的Zn转化为K2Zn(OH)4,写出该电池反应方程式:______.
(3)准确称取上述制备的样品(设仅含Ag2O2和Ag2O)?2.558g,在一定的条件下完全分解为Ag?和O2,得到224.0mLO2(标准状况下).计算样品中Ag2O2的质量分数(计算结果精确到小数点后两位).
参考答案:(1)检验是否洗涤完全,可取最后一次滤液,检验溶液中是否含有SO42-或OH-,滴入1~2滴Ba(NO3)2溶液,若不出现白色浑浊,表示已洗涤完全(或取少许最后一次洗涤滤液,滴入1~2滴酚酞溶液,若溶液不显红色,表示已洗涤完全),
故答案为:取少许最后一次洗涤滤液,滴入1~2滴Ba(NO3)2溶液,若不出现白色浑浊,表示已洗涤完全(或取少许最后一次洗涤滤液,滴入1~2滴酚酞溶液,若溶液不显红色,表示已洗涤完全);
(2)电池放电时正极的Ag2O2?转化为Ag,负极的Zn转化为K2Zn(OH)4,反应还应有KOH参加,反应的方程式为Ag2O2+2Zn+4KOH+2H2O=2K2Zn(OH)4+2Ag,
故答案为:Ag2O2+2Zn+4KOH+2H2O=2K2Zn(OH)4+2Ag;
(3)n(O2)=224.0mL22.4L/mol×1000mL/L=1.000×10-2mol,
设样品中Ag2O2的物质的量为x,Ag2O?的物质的量为y
248?g/mol×x+232g/mol×y=2.588g
x+y2=1.000×10-2mol
x=9.500×10-3mol
y=1.000×10-3mol
w(Ag2O2)=m(Ag2O2)m(样品)=9.500×10-3mol×248g/mol2.588g=0.91.
答:样品中Ag2O2的质量分数为0.91.
本题解析:
本题难度:一般
4、填空题 能源短缺是人类面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列两种反应合成甲醇:
反应I:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH1
CH3OH(g)+H2O(g) ΔH1
反应II:CO(g)+2H2(g) CH3OH(g) ΔH2
CH3OH(g) ΔH2
上述反应符合“原子经济”原则的是__________(填“Ⅰ”或“Ⅱ”),
(2)下表所列数据是反应Ⅱ在不同温度下的化学平衡常数(K)
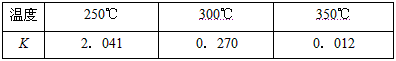
①由表中数据判断ΔH2_______0(填“>”、“<”或“=”),
②若容器容积不变,下列措施可增加甲醇产率的是______________,
A.升高温度
B.将CH3OH(g)从体系中分离
C.使用合适的催化剂
D.充入He,使体系总压强增大
E.按原比例再充入CO和H2
③某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)=
0.2mol·L-1,则CO的转化率为____________,此时的温度为____________(从上表中选择);
(3)某实验小组依据甲醇燃烧的反应原理,设计如图所示的原电池装置。
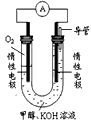
①该电池工作时,OH-向_______极移动(填“正”或“负”),
②该电池正极的电极反应式为___________________。
参考答案:(1)①Ⅱ
(2)①<;②BE;③80%;250℃
(3)①负;②O2+2H2O+4e-→4OH-
本题解析:
本题难度:困难
5、选择题 下列有关说法正确的是
A.铅蓄电池放电时,正极和负极的电极质量均增大
B.反应Cl2(g)+H2O(1)=HCl(aq)+HClO(aq)在常温下能自发进行,则该反应的△H>0
C.加热Fe2(SO4)3溶液,Fe3+的水解程度和溶液的pH均增大
D.C2H5Br水解生成乙醇(△H>0),加入少量NaOH浓溶液并加热,该化学反应速率增大其平衡常数不变