1、选择题 下列物质中,既能与稀硫酸反应,又能与氢氧化钠溶液反应的是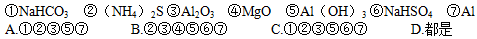
2、简答题 (14分)
一位同学在复习时遇到这样一道习题:某无色溶液中可能含有“H+、OH-、Na+、NO3-”,加入铝粉后,只产生H2,问该无色溶液中能大量存在哪几种离子。
(1)加入铝粉产生H2,说明铝具有______(填“氧化性”或“还原性”)。
(2)该同学分析:若H+大量存在,则NO3-就不能大量存在。
设计实验证实如下:
装 置
| 现 象
|
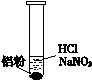
| ⅰ. 实验初始,未见明显现象
ⅱ. 过一会儿,出现气泡,液面上方呈浅棕色
ⅲ. 试管变热,溶液沸腾
|
?
① 盐酸溶解Al2O3薄膜的离子方程式是______。
② 根据现象ⅱ,推测溶液中产生了NO,为进一步确认,进行如下实验:
实?验
| 内?容
| 现?象
|
实验1
| ?将湿润KI—淀粉试纸置于空气中
| 未变蓝
|
实验2
| 用湿润KI—淀粉试纸检验浅棕色气体
| 试纸变蓝
|
?a. 浅棕色气体是______。
b. 实验1的目的是_______。
c. 实验1、2说明反应生成了NO,将生成NO的离子方程式补充完整:
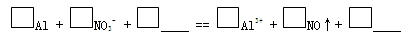
(3)再假设:若OH-大量存在,NO3-也可能不能大量存在。
重新设计实验证实如下:
装 置
| 现 象
|
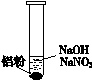
| ⅰ. 实验初始,未见明显现象
ⅱ. 过一会儿,出现气泡,有刺激性气味
|
?
为确认“刺激性气味”气体,进行如下实验:用湿润KI—淀粉试纸检验,未变蓝;用湿润红色石蕊试纸检验,试纸变蓝。
① 刺激性气味的气体是______。
② 产生该气体的离子方程式是______。
(4)在NaOH溶液中加入铝粉,结果只检验出有H2生成,其化学方程式是______。
(5)实验结果证实:NO3?在酸、碱性环境中都有一定的氧化性,能氧化铝单质,产生含氮化合物。习题中的无色溶液一定能大量存在的是Na+和OH-。
3、选择题 铝分别与足量的氢氧化钠和稀盐酸溶液反应,当两个反应放出的气体在相同状况下体积相等时,反应中消耗的NaOH和HCl物质的量之比为( )
A.2:1
B.3:1
C.1:1
D.1:3
4、选择题 下列物质中,既能与盐酸又能与NaOH溶液反应的是
A.氢氧化铝
B.硅酸钠
C.碳酸钠
D.二氧化硅
5、填空题 (16分 )镁可与其他金属构成合金。镁铝合金的强度高,机械性能好。有“国防金属”的美誉。自然界中的镁元素主要存在于海水中。海水中镁的总储量约为1.8×1015?t。从海水中(主要含含Na+,Cl—,Mg2+等离子)提取镁的工艺流程图如下:
)镁可与其他金属构成合金。镁铝合金的强度高,机械性能好。有“国防金属”的美誉。自然界中的镁元素主要存在于海水中。海水中镁的总储量约为1.8×1015?t。从海水中(主要含含Na+,Cl—,Mg2+等离子)提取镁的工艺流程图如下:
(1)A物质的化学式为?。操作1的名称为?。
(2)试写出向固体A中加入足量盐酸的离子方程式?。
(3)该反应的副产物主要有?等。
(4)若开始得到的固体A的质量为116g,不考虑物质的损失,则最后生成的Mg的物质的量为?mol。