1、填空题 甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列两种反应合成甲醇:
反应I:CO(g)+2H2(g) CH3OH(g) △H1
CH3OH(g) △H1
反应Ⅱ:CO2(g) +3H2(g)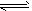 CH3OH(g) +H2O(g) △H2
CH3OH(g) +H2O(g) △H2
①上述反应符合“原子经济”原则的是__________(填“I” 或“Ⅱ”)。
②下表所列数据是反应I在不同温度下的化学平衡常数(K)。
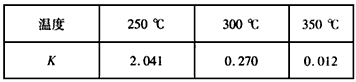
由表中数据判断△H1____(填“>”“=”或“<”)0。
③某温度下,将2 mol CO和6molH2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2
mol/L,则CO的转化率为___________,此时的温度为___________(从上表中选择)。
(2)已知在常温常压下:
①2CH3OH(l)+ 3O2(g)= 2CO2(g) +4H2O(g) △H1= -1275.6 kJ/mol
②2CO(g) +O2(g)=2CO2(g) △H2=-566.0 kJ/mol
③H2O(g)=H2O(l) △H3= -44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:_____________________________
(3)某实验小组依据甲醇燃烧的反应原理。设计如下图所示的电池装置,则该电池正极的电极反应为:
____________________

参考答案:(1)①I;②<;③80%;250℃
(2)CH3OH(l)+O2(g)=CO(g)+2H2O(l) ;△H =-442. 8 kJ/mol
(3)O2+2H2O+4e-=4OH-
本题解析:
本题难度:一般
2、填空题 在汽车上安装催化转化器可使汽车尾气中的主要污染物(CO、NOx、碳氢化合物)相互反应生成无毒害物质,减少汽车尾气污染。
(1)N2(g)+?O2(g)=2NO(g)?△H=+180.5?kJ/mol?
2C(s)+?O2(g)=2CO(g)?△H=-221.0?kJ/mol?
C(s)+?O2(g)=CO2(g)?△H=-393.5?kJ/mol?
写出NO(g)与CO(g)反应的热化学方程式____________________。
(2)某研究性学习小组在技术人员的指导下,在某温度时按下列流程探究催化剂作用下的反应速率,用气体传感器测得不同时间的NO和CO浓度如表

①前2s内的平均反应速率v?(N2)?=__________。
②列式计算该温度下反应的平衡常数K_______________。
③对于该可逆反应,下列叙述正确的是___________(填序号)。
A.该反应在一定条件下能自发进行
B.该反应能有效减少有害气体的排放
C.该反应一旦发生将在很短的时间内完成?
D.该反应达到平衡时CO、NO的转化率相等
(3)CO分析仪以燃料电池为工作原理,其装置如图所示,该电池中电解质为氧化钇-氧化钠,其中O2-可以在固体介质NASICON中自由移动。下列叙述错误的是____(填序号)。

A.负极的电极反应式为:CO+O2--2e-=CO2?
B.工作时O2-在固体介质中由电极a流向电极b
C.工作时电子由电极a通过电流计流向电极b
D.电流计中显示的电流越大,汽车尾气中CO的含量越高
参考答案:(1)2NO(g)+2CO(g)=N2(g)+2CO2(g)? △H=-746.5 kJ/mol
(2)①1.875×10-4 mol·L-1·s-1;②5.00 ×103;③ABC
(3)B
本题解析:
本题难度:一般
3、简答题 已知N2+3H2?2NH3,根据如图判断:
A是______的物质的量浓度变化情况.反应开始时,C(N2)=______;
2min时C(NH3)=______,0-2min内氢气的平均反应速率v(H2)=______.
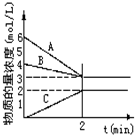
参考答案:随反应进行反应物的物质的量减小,生成物的物质的量增大,因此AB为反应物,C为生成物,反应消耗的物质的量之比等于化学计量数之比,图中变化量最大的为氢气;所以A为H2,B为N2,C为NH3;由图象可知反应开始时,C(N2)=4mol/L;2min时C(NH3)=2mol/L;
0-2min内氢气变化的浓度为△c(H2)=6-3mol/L=3mol/L,所以0-2min内氢气的平均反应速率v(H2)=△c(H2)t=3mol/L2min=1.5mol/(L?min);
故答案为:H2;4mol/L;2mol/L;1.5mol/(L?min).
本题解析:
本题难度:一般
4、选择题 已知NO2和N2O4可以相互转化:2NO2(g)?N2O4(g)△H<0.现将一定量NO2和N2O4的混合气体通入一体积为1L的恒温密闭容器中,反应物浓度随时间变化关系如图所示.X与Y两条曲线中,Y表示N2O4浓度随时间的变化,则下列说法不正确的是( ? )
A.如混合气体的压强不变,说明反应已达化学平衡状态
B.a、b、c、d四个点中,表示化学反应处于平衡状态的点是b点
C.25~30?min内用N2O4表示的平均化学反应速率是0.04?mol?L-1?min-1
D.反应进行至25?min时,曲线发生变化的原因是增加N2O4浓度