|
高考化学试题《热化学方程式》练习题(二)
2019-07-04 00:02:43
【 大 中 小】
|
1、选择题 已知C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g) ΔH1=-a kJ/mol
C2H5OH(g)=C2H5OH(l) ΔH2=-b kJ/mol
H2O(g)=H2O(l) ΔH3=-c kJ/mol
若使92 g酒精液体完全燃烧,最后恢复到室温,则放出的热量(单位kJ)为( )
A.4a+4b+4c
B.2a-2b+6c
C.2a-2b+2c
D.2a-6b+2c
|
参考答案:B
本题解析:酒精液体完全燃烧恢复到室温,生成的产物为CO2(g)和H2O(l),根据已知的热化学方程式可知:
C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g) ΔH1=-a kJ/mol ①,C2H5OH(g)=C2H5OH(l) ΔH2=-b kJ/mol ②,H2O(g)=H2O(l) ΔH3=
-c kJ/mol ③。常温下C2H5OH(l)完全燃烧生成CO2(g)和H2O(l)的热化学方程式为①-②+3×③,C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l)
ΔH=-(a-b+3c) kJ·mol-1,92 g C2H5OH的物质的量为2 mol,反应放出的热量为(2a-2b+6c) kJ,B项正确。
本题难度:一般
2、填空题 (14分)煤是一种重要的化工原料,人们将利用煤制取的水煤气、焦炭、甲醚等广泛用于工农业生产中。
(1)已知:

①C(s) + H2O(g) === CO(g)+H2(g) ΔH=+131.3 kJ·mol-1
②CO2(g) + H2(g) ===" CO(g)" + H2O(g) ΔH=+41.3 kJ·mol-1
则碳与水蒸气反应生成二氧化碳和氢气的热化学方程式为 。
该反应在 (填“高温”、“低温”或“任何温度”)下有利于正向自发进行。
(2)有人利用炭还原法处理氮氧化物,发生反应C(s)+2NO(g)  N2(g)+CO2(g)。向某密闭容器中加入一定量的活性炭和NO,在T1℃时,不同时间测得各物质的浓度如下表所示: N2(g)+CO2(g)。向某密闭容器中加入一定量的活性炭和NO,在T1℃时,不同时间测得各物质的浓度如下表所示:
时间(min)
浓度(mol·L-1)
| 0
| 10
| 20
| 30
| 40
| 50
| NO
| 1.00
| 0.68
| 0.50
| 0.50
| 0.60
| 0.60
| N2
| 0
| 0.16
| 0.25
| 0.25
| 0.30
| 0.30
| CO2
| 0
| 0.16
| 0.25
| 0.25
| 0.30
| 0.30
|
①10~20min内,N2的平均反应速率v(N2)= 。
②30 min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是 (填字母序号)。
A.通入一定量的NO B.加入一定量的活性炭
C.加入合适的催化剂 D.适当缩小容器的体积
(3)研究表明:反应CO(g)+H2O(g)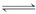 H2(g)+CO2(g)平衡常数随温度的变化如下表所示: H2(g)+CO2(g)平衡常数随温度的变化如下表所示:
若反应在500℃时进行,设起始时CO和H2O的浓度均为0.020 mol·L-1,在该条件下达到平衡时,CO的转化率为 。
(4)用CO做燃料电池电解CuSO4溶液、FeCl3和FeCl2混合液的示意图如图1所示,其中A、B、D均为石墨电极,C为铜电极。工作一段时间后,断开K,此时A、B两极上产生的气体体积相同。

①乙中A极产生的气体在标准状况下的体积为________________。
②丙装置溶液中金属阳离子的物质的量与转移电子的物质的量变化关系如图2所示,则图中③线表示的是________(填离子符号)的变化;反应结束后,要使丙装置中金属阳离子恰好完全沉淀,需要________ mL 5.0 mol·L-1 NaOH溶液。
参考答案:(1)C(s) + 2H2O(g) = CO2(g) + 2H2(g)
本题解析:
本题难度:困难
3、填空题 (1)已知拆开1mol H-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2
与H2反应生成NH3的热化学方程式为______________.
(2)已知下列反应的反应热为:
①CH3COOH(l)+2O2(g)= 2CO2(g)+2H2O(l) △H=- 870.3 kJ·mol-1
②C(s)+O2(g) = CO2(g) △H=-393.5 kJ·mol-1
③H2(g)+O2(g) = H2O(l) △H=-285.8 kJ·mol-1
试计算下列反应的反应热:2C(s)+2H2(g)+O2(g) = CH3COOH(l) △H= __________。
参考答案:(1)N2(g)+3H2(g) 2NH3(g) △H=-92KJ/mol? 2NH3(g) △H=-92KJ/mol?
(2) -488.3KJ/mol
本题解析:
本题难度:一般
4、填空题 碳化硅(SiC) 、氧化铝(Al2O3) 和氮化硅(Si3N4)是优良的高温结构陶瓷,在工业生产和科技领域有重要用途。宇宙火箭和导弹中,大量用钛代替钢铁。
(1)Al的离子结构示意图为 ;
Al与NaOH溶液反应的离子方程式为
(2)氮化硅抗腐蚀能力很强,但易被氢氟酸腐蚀,氮化硅与氢氟酸反应生成四氟化硅和一种铵盐,
其反应方程式为
(3)工业上用化学气相沉积法制备氮化硅,其反应如下:
3SiCl4(g) + x N2(g) + 6 H2(g)  Si3N4(s) + 12 HCl(g) △H<0 Si3N4(s) + 12 HCl(g) △H<0
在恒温、恒容时,分别将0.3mol SiCl4(g)、0.2mol N2(g)、0.6mol H2(g)充入2 L密闭容器内,进行上述反应,5 min达到平衡状态,所得HCl(g)为0.3mol/L、 N2为0.05 mol/L
① H2的平均反应速率是
② 反应前与达到平衡时容器内的压强之比=
③ 系数 x =
(4)已知:TiO2(s)+2Cl2(g)===TiCl4(l)+O2(g) ΔH1=+140 kJ·mol-1
C(s)+ O2(g)=== CO(g) ΔH2 =-110 kJ·mol-1 O2(g)=== CO(g) ΔH2 =-110 kJ·mol-1
写出TiO2和焦炭、氯气反应生成TiCl4和CO气体的热化学方程式:
。
参考答案:(共10分)(1) (1分) 2Al +2OH-+2H2O=2AlO2 + 3H2↑ (2分) (1分) 2Al +2OH-+2H2O=2AlO2 + 3H2↑ (2分)
(2)Si3N4 +16HF=3SiF4 + 4NH4F (2分)
(3)①0.03mol/(L·min) ②11:12 ③x=2 (1分/空,若没有带单位不得分)
(4)TiO2(s)+2Cl2(g)+2 C(s) ===TiCl4(l)+ 2 CO(g) ΔH = - 80 kJ·mol-1(2分)
本题解析:(1)铝离子的核外电子数是8个,所以离子结构示意图为 。金属铝能和氢氧化钠溶液反应生成氢气和偏铝酸钠,反应的离子方程式是2Al +2OH-+2H2O=2AlO2 + 3H2↑。 。金属铝能和氢氧化钠溶液反应生成氢气和偏铝酸钠,反应的离子方程式是2Al +2OH-+2H2O=2AlO2 + 3H2↑。
(2)氮化硅与氢氟酸反应生成四氟化硅和一种铵盐,则根据原子守恒可知,该铵盐应该是氟化氨,因此反应的化学方程式是Si3N4 +16HF=3SiF4 + 4NH4F。
(3) 3SiCl4(g) + x N2(g) + 6 H2(g)  Si3N4(s) + 12 HCl(g) Si3N4(s) + 12 HCl(g)
起始量(mol) 0.3 0.2 0.6 0 0
转化量(mol/L) 0.15 0.05x 0.3 0.05 0.6
平衡量(mol/L) 0.15 0.2-0.05x 0.3 0.05 0.6
则① H2的平均反应速率是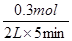 =0.03mol/(L·min) =0.03mol/(L·min)
② 反应前与达到平衡时容器内的压强之比是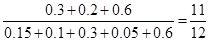
③0.2-0.05x=0.1
解得x=2
(4)根据盖斯定律可知,①+②×2即得到反应TiO2(s)+2Cl2(g)+2 C(s) ===TiCl4(l)+ 2 CO(g),所以该反应的反应热ΔH =140 kJ/mol -110 kJ/mol×2=-80 kJ·mol
考点:考查离子结构示意图、方程式的书写,反应速率、反应热的有关计算
点评:该题是高考中的常见题型,属于中等难度的试题。试题基础性强,在注重考查学生基础知识的同时,侧重考查学生灵活运用基础知识解决实际问题的能力。有助于培养学生的逻辑推理能力,和规范的答题能力。
本题难度:困难
5、填空题 (8分)、(1)写出下列反应的热化学方程式
①1molN2 (g)与适量O2 (g)反应生成NO(g),需吸收68kJ的热量
②1g 硫粉在氧气中充分燃烧放出 9.36kJ热量
(2)氢氧燃料电池是将H2通入负极,O2通入正极而发生电池反应的,其能量转换率高。
①若电解质溶液为KOH,其正极反应方程式为:
②若电解质溶液为硫酸,负极反应方程式为: 。
参考答案:(1)①N2(g)+ O2(g)=2NO(g) △H =+68kJ/mol
② S(s)+ O2(g)=S O2(g)△H =-299.52 kJ/mol
(2) ① O2 + 4 e-+ 2 H2O=4OH- ②2 H2-4e-= 4 H+ (每小题2分)
本题解析:考查热化学方程式即电极反应式的书写。热化学方程式是表示化学反应与反应热关系的方程式。书写和应用热化学方程式时必须注意以下几点:
①明确写出反应的计量方程式,各物质化学式前的化学计量系数可以是整数,也可以是分数。
②各物质化学式右侧用圆括弧()表明物质的聚集状态。可以用g、l、s分别代表气态、液态、固态。固体有不同晶态时,还需将晶态注明,例如S(斜方),S(单斜),C(石墨),C(金刚石)等。溶液中的反应物质,则须注明其浓度,以aq代表水溶液,(aq) 代表无限稀释水溶液。
③反应热与反应方程式相互对应。若反应式的书写形式不同,则相应的化学计量系数不同,故反应热亦不同。
④热化学方程式必须标明反应的浓度、温度和压力等条件,若在常温常压时可省略。
(1)①反应是吸热的,所以热化学方程式是N2(g)+ O2(g)=2NO(g) △H =+68kJ/mol
②1g 硫粉在氧气中充分燃烧放出 9.36kJ热量,则1molS燃烧放出的热量是 9.36kJ×32=299.52 kJ,所以热化学方程式是S(s)+ O2(g)=S O2(g)△H =-299.52 kJ/mol
(2)原电池中负极失去电子,正极得到电子,所以氢气在负极通入,氧气在正极通入,如果电解质溶液为KOH,则正极反应方程式为 O2 + 4 e-+ 2 H2O=4OH-;电解质溶液为硫酸,则负极反应方程式为2 H2-4e-= 4 H+。
本题难度:一般
|  H2(g)+CO2(g)平衡常数随温度的变化如下表所示:
H2(g)+CO2(g)平衡常数随温度的变化如下表所示: